10月CDE药品审评情况分析报告
来源:药智网 | 发布时间:2021-11-05
摘要:10月药审中心受理总量为917个。 10月60个化药1类新药品种获CDE受理,均为IND申请。 10月有58个1类治疗用生物制品受理号获得承办,其中44个国产新药申请,3个进口。 10月新增74个按仿制药质量和疗效一致性评价品种申报的受理号。
根据药智数据最新统计,2021年10月份CDE共承办新的药品注册申请以受理号计有917个;其中化药受理579个,中药受理190个,生物制品受理148个;2021年1-10月各类药品注册申请受理情况详见图一。
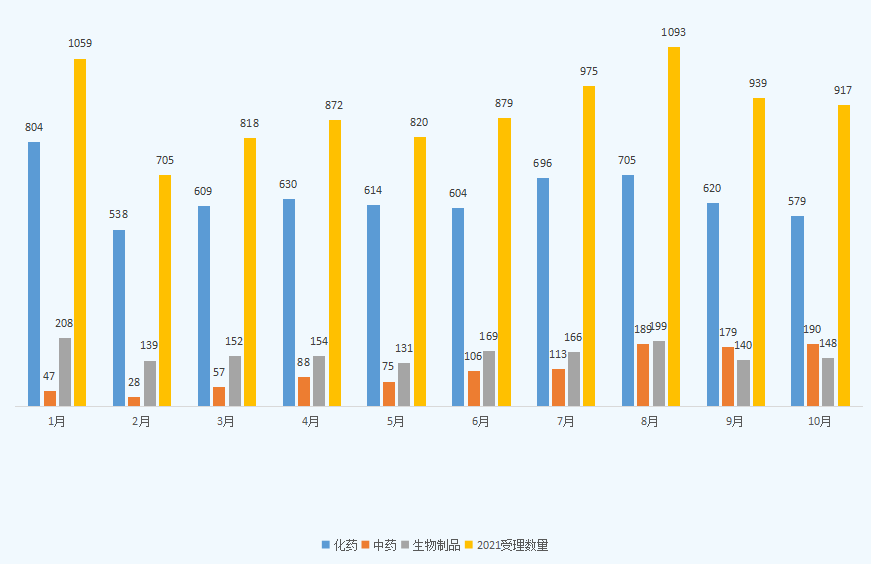
图一 2021年1-10月CDE药品受理情况
以下且看化药、中药、生物制品的注册受理及审评情况详细分析。
一、化药审评情况
10月份CDE共承办新的化药注册申请以受理号计有579个,与上月申报数量相比有所降低,主要申请类型仍旧以补充申请为主,约占化药申请总量的45%,有263个受理号,数量较9月的315个受理号有所降低,其次为仿制申请,受理号134个,新药申请共有受理号85个;2021年1-10月CDE化药各申请类型受理情况详见图二。
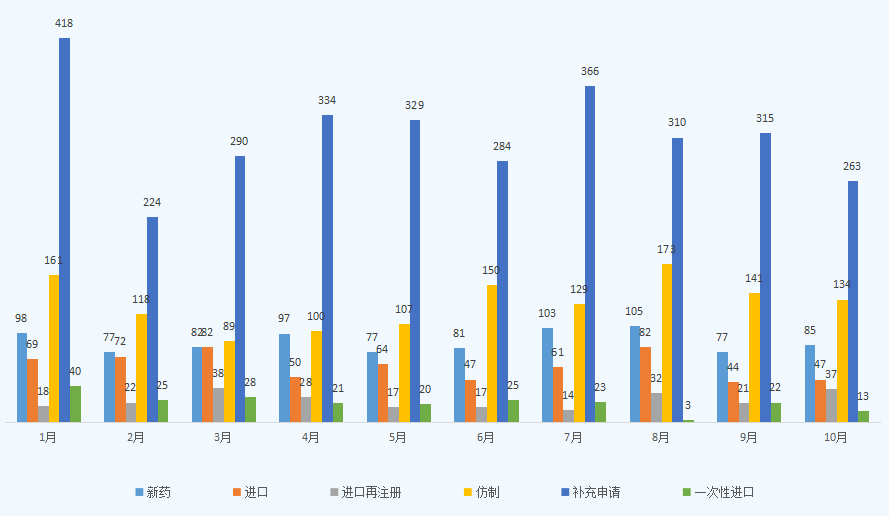
图二 2021年1-10月CDE化药各申请类型受理情况
1.化药1类国产申报情况
10月CDE受理化药国产1类新药共计61个(按受理号计),均为IND申请,涉及35个品种31家企业;下表为10月新承办的1类国产新药。
表一 2021年10月新承办的化药1类国产新药

注:排队序号截止至2021年11月03日
2.化药1类进口药品申报情况
10月共20个进口化药1类受理号获得承办,均为IND;涉及12个品种10家企业;下表为10月新承办的1类进口新药。
表二 2021年10月新承办的化药1类进口新药

注:排队序号截止至2021年11月03日
THDBH130 片
THDBH130 片由上海药明康德新药研发公司研发,并于 2021 年 6 月 30 日签署的《THDB130/THDB131 一 类新药研发项目技术转让合同书》约定将THDBH130 片转让给东宝紫星(杭州)生物医药有限公司,并由东宝紫星(杭州)生物医药有限公司委托南京明德新药研发有限公司申报临床申请获得受理;THDBH130 片是一款 URAT1 抑制剂,目前以 URAT1 为靶点的排尿酸药物主要有苯溴马隆和雷西那德(尚未在国内上市);市场上在研的以 URAT1 为靶点的产品有恒瑞的 SHR4640 片、益方生物的 D-0120-NA 片、上海璎黎药 业的 YL90148 片、成都海创药业的 HP501 缓释片、天津药物研究院的泰宁纳德片等。
NH600001乳状注射液
恩华今年第二个申报的1类新药,拟用于麻醉镇痛。
TCR1672片
TCR1672片首次在国内申报临床,是公司自主研发的一款二代高选择性P2X3受体拮抗剂,9月8日刚刚向美国FDA递交IND申请并获受理;通过阻断三磷酸腺苷(ATP)启动P2X3受体产生的钙离子内流,从而发挥对其特异性抑制作用来起到治疗效果;目前该药主要应用于临床空白的两大适应症领域,治疗呼吸领域的难治性慢性咳嗽(RCC)成年患者及疼痛领域的子宫内膜异位症等复杂性内脏痛患者。
SCR-6852胶囊
SIM0270是先声药业自主研发的新一代口服选择性雌激素受体降解剂(SERD),计划用于治疗ER+/HER2-型局部晚期或转移性乳腺癌。临床前研究数据表明, SIM0270(SCR-6852)具有高活性、高血脑屏障通透性和良好的安全性,作用优于第一代SERD药物,且有望用于治疗乳腺癌脑转移。目前全球已开展的二代SERD药物临床试验均未纳入已知有症状脑转移患者。SIM0270是当前唯一具备透脑特性的SERD分子,将在下一步的临床试验中同时探索在乳腺癌脑转移人群中的疗效。
注射用XNW4107
XNW4107是一款新一代的β-内酰胺酶抑制剂,临床前实验数据显示出对革兰氏阴性菌强大的杀伤能力,并且对鲍曼不动杆菌、铜绿假单胞菌、肠杆菌科细菌这3种WHO提出的最需要紧迫解决的排名前三的耐药菌同时有效;目前已获得美国FDA 对复杂尿路感染 (cUTI)和医院或呼吸机获得性肺炎(HABP/VABP)两个适应症的QIDP(Qualified Infectious Drug Product)和FTD(Fast Track Designation)批准。
BGB-16673薄膜包衣片
BGB-16673薄膜包衣片是百济神州靶向BTK的蛋白降解剂,早在今年8月,就在美国临床网(ClinicalTrials.gov)进行了登记,适应症包括B细胞淋巴瘤、边缘区淋巴瘤滤泡性淋巴瘤等。这是百济神州首个基于其蛋白降解CDAC(创新PROTAC)平台开发且进入临床阶段的在研产品,该技术平台针对难以成药或易耐药的靶标,并构建了新型E3连接酶。PROTAC通过两种配体与靶蛋白与泛素E3连接酶同时结合,形成稳定的靶蛋白-PROTAC-E3连接酶三元复合物,诱导泛素化并由蛋白酶体降解,有望突破不可成药的蛋白靶标。国内目前布局PROTAC技术除百济神州外,还有开拓药业、海思科、分迪科技、和径药业、海创药业、凌科药业等企业。其中,临床进展居前的PROTAC药物包括海思科的HSK29116和开拓药业的GT20029。
二、中药审评情况
10月份CDE承办新的中药注册申请受理号共计190个,新药申报数量为4个,其余均为补充申请,共有186个;2021年1-10月CDE中药各申请类型受理情况详见图三。
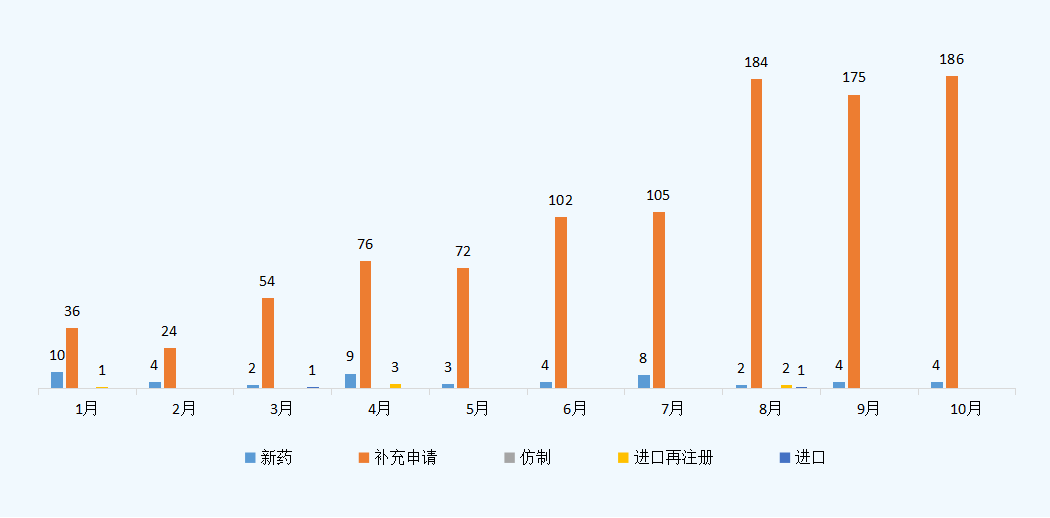
图三 2021年1-10月CDE中药各申请类型受理情况
10月共4个中药1类创新药受理号获得承办,均为IND申请;下表为10月新承办的中药1类创新药。
表三 2021年10月新承办的中药1类创新药

注:排队序号截止至2021年11月03日
三、生物制品审评情况
10月份CDE承办新的生物制品注册申请受理号共计148个,新药58个,补充申请66个,进口10个,一次性进口14个;2021年1-10月CDE生物制品各申请类型受理情况详见图四。
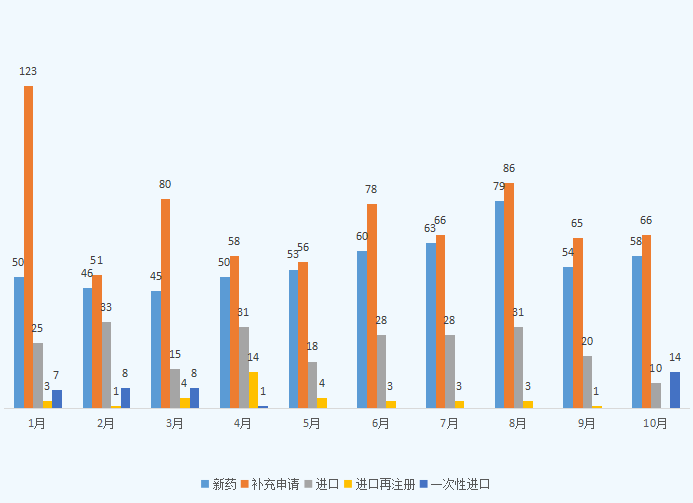
图四 2021年1-10月CDE生物制品各申请类型受理情况
10月有44个国产1类治疗用生物制品新药受理号获得承办,其中临床试验申请42个,上市申请2个;下表为10月新承办的生物制品1类创新药。
表四 2021年10月新承办的治疗用生物制品1类新药

注:排队序号截止至2021年11月03日。
10月有3个1类治疗用进口生物制品受理号获得承办,均为临床试验申请,目前均已进入相应序列排队待审;下表为10月新承办的进口生物制品1类创新药。
表五 2021年10月新承办的进口治疗用生物制品1类新药

注:排队序号截止至2021年11月03日。
TST005注射液
TST005注射液临床试验申请适应症是实体瘤。TST005是第二个启动全球临床研究的双功能抗PD-L1和TGF-β trap融合蛋白,同时靶向两个通常被癌细胞用于逃逸免疫抑制的通路,即转化生长因子-β(TGF-β)及程序性细胞死亡配体-1(PD-L1)。它由高亲和力PD-L1抗体,和融合在其C端的经工程改造的TGF-β受体II型蛋白组成,不结合Fc受体,因此其由Fc受体介导的对表达PD-L1蛋白的效应T细胞的杀伤风险更低。
LBL-019注射液
LBL-019注射液是南京维立志博自主研发、拥有全球知识产权的TNFR2单克隆抗体(Tumor necrosis factor receptor 2),是国内首个申报临床的靶向TNFR2的一类新药。这是一种高亲和力抗TNFR2人源化单克隆抗体,其作用靶点明确,选择特异性高;在体外实验中可显著促进效应T细胞的活化和增殖,在小鼠肿瘤模型中,单药即显示出显著的抗肿瘤效果,与PD-1抗体联用具有进一步的协同作用;在食蟹猴上完成的GLP临床前安全性评价显示,最大剂量200 mg/kg下无明显毒副作用。TNFR2是肿瘤免疫治疗的重要临床靶标,目前多个靶向TNFR2的单克隆抗体处于临床前或早期临床开发阶段。
SIM1811-03注射液
先声药业自主研发的抗肿瘤创新药物SIM0235(即SIM1811-03)用于治疗晚期实体瘤及皮肤T细胞淋巴瘤。SIM0235是一种免疫球蛋白G1(IgG1)型人源化抗TNFR2单克隆抗体,能够特异性识别表达在细胞表面的TNFR2,通过抗体依赖性细胞介导的细胞毒作用(ADCC)、抗体依赖性细胞介导的吞噬作用(ADCP)等在内的Fc端功能,对表达TNFR2的调节性T细胞(Treg)、骨髓来源抑制细胞等免疫抑制细胞发挥杀伤作用,同时还可以通过阻断内源性肿瘤坏死因子(TNF)对TNFR2的激活作用,影响TNFR2介导的免疫抑制功能及增殖,增强机体对肿瘤的免疫反应,发挥抗肿瘤作用。此外,SIM0235还能够特异性识别表达在肿瘤细胞表面的TNFR2,直接杀伤肿瘤。
TJ033721注射液
TJ033721(TJ-CD4B)注射液是天境生物的CLDN18.2/4-1BB双特异性抗体,为国内首家。TJ033721是临床阶段唯一一款靶向肿瘤抗原密蛋白18剪切体2(Claudin 18.2)和T细胞共刺激分子4-1BB的创新双特异性抗体,其同时与这两个靶点特异结合后,可增加淋巴细胞肿瘤浸润并增强肿瘤免疫应答。
JS019注射液
JS019注射液的活性成分为重组全人源抗CD39单克隆抗体。CD39为负责在肿瘤微环境中将免疫刺激性细胞外三磷酸腺苷(ATP)转化为免疫抑制腺苷(ADO)的初始步骤的酶,CD39在各种人类肿瘤中均呈现高表达现象,包括淋巴瘤、肉瘤、肺癌、胰腺癌、卵巢癌、肾细胞癌、甲状腺癌和睾丸癌等。
ZG005粉针剂
ZG005 是重组人源化抗 PD-1/TIGIT 双特异性抗体粉针剂,为创新型肿瘤免 疫治疗生物制品,注册分类为 1 类,有望用于治疗多种实体瘤。目前全球范围内尚未有同类机制药物获批上市。ZG005 拥有双靶向阻断 PD-1 和 TIGIT 的作用,既可以通过有效阻断 PD-1 与其配体 PD-L1 的信号通路,进而促进 T 细胞的活化和增殖;又可以有效阻断 TIGIT 与其配体 PVR 等的信号通路,促使 PVR 结合 CD226 产生共刺激激活信 号,进而促进 T 细胞和 NK 细胞的活化和增殖,并产生两个靶点被同时阻断后的 协同增强免疫系统杀伤肿瘤细胞的能力。
四、按一致性评价申报品种情况
10月新增74个按一致性评价要求进行申报的受理号和159个视同受理号。(篇幅限制仅展示一致性信息,视同及具体信息请关注药智企业版药品注册与受理数据库);2021年1-10月一致性评价受理数量详见图五;表五为10月新增一致性评价受理号信息。
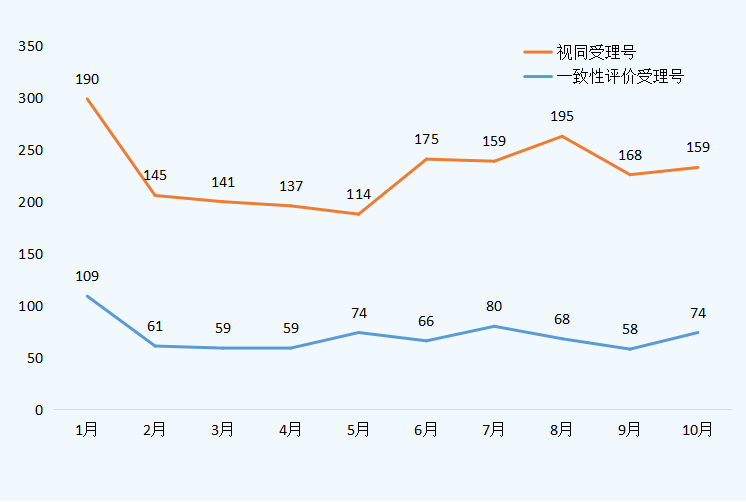
图五 2021年1-10月一致性评价受理数量
表六 2021年10月新增一致性评价受理数据
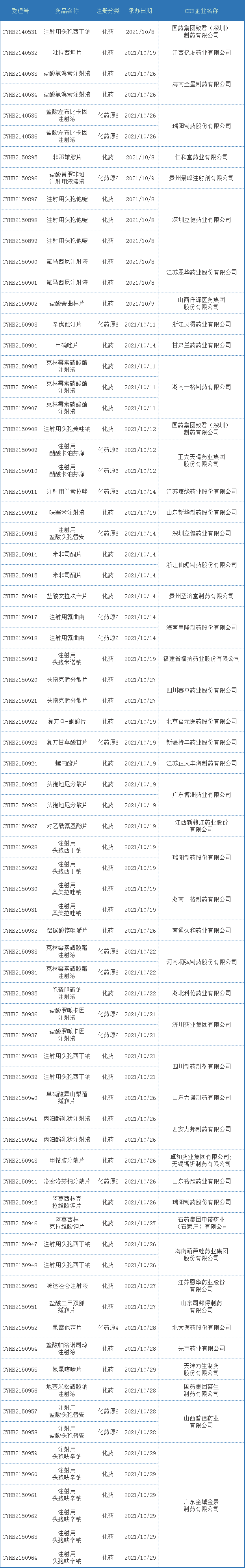
注:排队序号截止至2021年11月03日。