9月CDE药审报告:12个新药获批上市
来源:药智数据 | 发布时间:2025-10-31
摘要:9月药审速览:CDE本月共受理药品注册申请1168个品种,包括161个1类创新药、50个2类改良型新药及5个中药3类经典名方新药。 在审批方面,本月完成审批的品种共计1286个品种,其中批准临床299个品种、批准生产345个品种、批准进口17个品种、未被批准80个品种。
01
受理情况
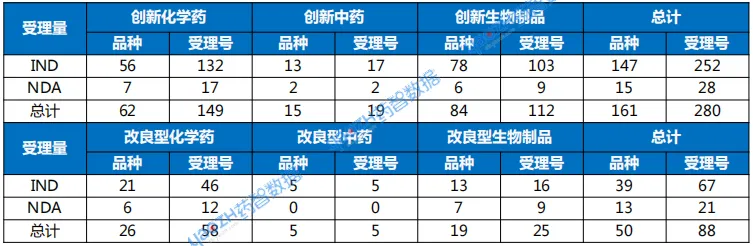
CDE共受理药品注册申请1168个品种(受理号1643个)。按药品类型统计,化药仍为主体,达654个品种;中药305个品种;生物制品207个品种。按审评任务类型统计,受理新药临床试验申请(以下简称IND)191个品种;新药上市许可申请(以下简称NDA)44个品种;同名同方药、仿制药、生物类似药上市许可申请(以下简称ANDA)279个品种;仿制药质量和疗效一致性评价注册申请(以下简称一致性评价申请)17个品种。
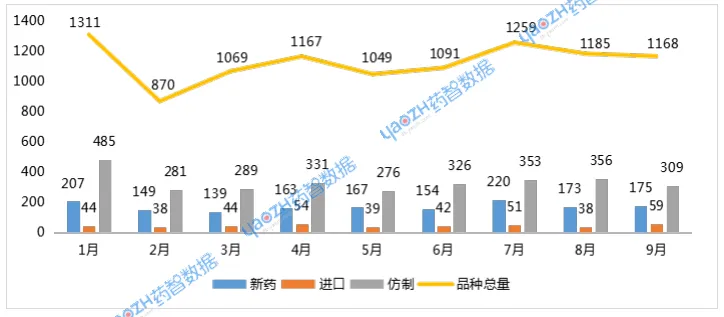
以注册分类统计,1类创新药受理161个品种。IND申请147个品种,NDA申请15个品种。2类改良型新药注册申请受理50个品种,化药申请26个品种,中药申请5个品种,生物制品申请19个品种。
亮点速览:
- 九典制药「椒七止痛凝胶贴膏」适用于缓解膝骨关节炎引起的疼痛。本次申报是基于Ⅲ期临床试验总结,其在疼痛缓解和改善患者活动能力上优于安慰剂组,且用药安全性较好。
- 艾伯维旗下双特异性抗体药物「艾可瑞妥单抗注射液」新适应症申报上市,拟联合利妥昔单抗和来那度胺适用于治疗复发或难治性滤泡性淋巴瘤(FL)成人患者。
- 减重白热化,恒瑞医药自研GLP-1、GIP双重受体激动剂——「HRS9531注射液」已获受理,与安慰剂相比,HRS9531所有剂量组在共同主要终点及全部关键次要终点均达到优效性。
- 心血管龙头信立泰「泰卡西单抗」报产。泰卡西单抗(SAL003)是信立泰自主研发的一款重组全人源抗PCSK9单克隆抗体,其单药与联合他汀用药的3期临床试验均达到主要疗效终点。
表1 2025年9月创新药与改良型新药注册申请受理情况
中药3类经典名方注册申请受理5个品种,为国药集团中联药业的开心散,河北万邦复临药业的芍药甘草颗粒,海南斯达制药和安徽宏信药业共同申报的半夏白术天麻颗粒,神威药业集团的异功散颗粒,西施兰(南阳)药业和绵阳一康制药共同申报的泻白散颗粒。
3类化学仿制药注册申请受理103个品种,4类化学仿制药受理206个品种。中药同名同方药暂无申请。生物制品3.3类生物类似药受理7个品种,其中预防用生物制品1个品种,治疗用生物制品6个品种。
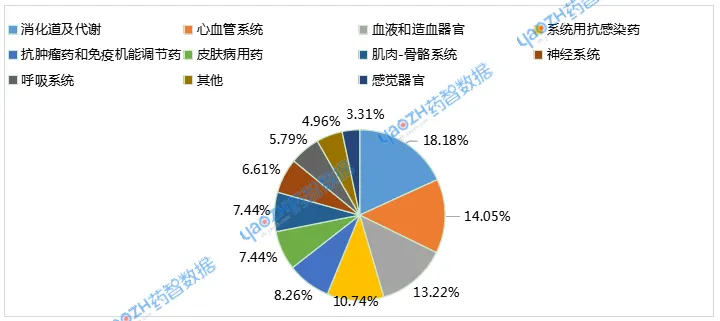
图2 2025年9月化学仿制药申报品种ATC分布情况
02
完成审批情况
NMPA完成审批1286个品种(受理号1683个),其中化药831个品种,中药242个品种,生物制品213个品种。以审评任务类型统计,IND申请完成审批232个品种,NDA申请28个品种,ANDA申请380个品种,一致性评价品种52个品种。按药智审评结论统计,批准临床299个品种,批准生产345个品种,批准进口17个品种,未被批准80个品种。
以注册分类统计,1类创新型新药完成审批185个品种,IND申请完成审批179个品种,临床申请批准率为98%;NDA申请6个品种,上市批准率为83%。2类改良型新药完成审批50个品种,IND申请完成审批45个品种,临床批准率为100%;NDA申请完成审批5个品种,上市批准率为80%。中药经典名方完成审批4个品种,上市批准率为75%。
新药上新
- 复星医药控股子公司锦州奥鸿药业有限责任公司开发的创新型小分子CDK4/6抑制剂复妥宁®「枸橼酸伏维西利胶囊」新适应症获得国家药品监督管理局批准,助力谱写我国HR+/HER2-晚期乳腺癌内分泌治疗失败患者新未来
- 海思科的1类创新药思舒静®「安瑞克芬注射液」,增加适应症为“治疗成人维持性血液透析患者的慢性肾脏疾病相关的中度至重度瘙痒”。该新获批适应症于2024年7月被纳入优先审评审批程序,现获批上市。
- 作为国内首款自主研发的磷酸二酯酶4(PDE4)小分子创新药,也是全球首个具备磷酸二酯酶4B(PDE4B)蛋白表达阻断剂和PDE4抑制剂双重机制的小分子药物,赣州和美药业股份有限公司的「莫米司特片」为中重度斑块状银屑病患者带来全新治疗方案。
- 吉林敖东控股子公司洮南药业申报的「升陷汤颗粒」获批上市。升陷汤是近代著名中医学家张锡纯(1860-1933)在其著作《医学衷中参西录》中创立的经典方剂,专为治疗“大气下陷”证而设。
3类化学仿制药申请完成审批169个品种,批准临床15个品种,批准生产136个品种,未被批准18个品种。4类化学仿制药申请完成审批217个品种,批准临床2个品种,批准生产194个品种,未被批准22个品种。中药同名同方药完成审批的1个品种,为云南楚雄天利药业的双黄连口服液,未被批准。3.3类生物制品生物类似药完成审评9个品种,批准临床5个品种,批准生产3个品种,未被批准1个品种。
表2 2025年9月新药上市申请审评结论情况
03
优先审评与突破性治疗品种名单
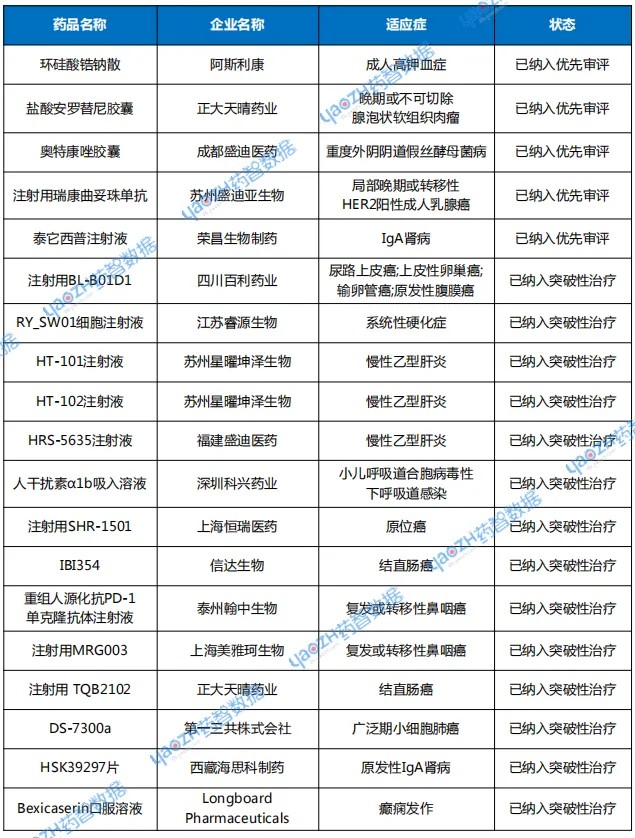
CDE共将5个品种正式纳入优先审评。其中共计3个化药品种,2个生物制品品种,中药未有品种纳入优先审评。纳入优先审评理由涉及“附条件批准”“纳入突破性治疗药物程序”等。
突破性治疗品种名单有14个品种,仅有4个化药品种,生物制品共计10个品种。涉及慢性乙型肝炎、实体瘤等适应症。
表3 2025年9月优先审评与突破性治疗品种名单