2023年基因治疗领域重大系列进展
来源:BiG生物创新社 | 发布时间:2024-01-10
摘要:在全球范围内,2023年共有7款CGT产品迎来首次监管获批,创下新高。本文通过ex-vivo和in-vivo两个方面来详细介绍2023年基因治疗领域取得的最新进展。
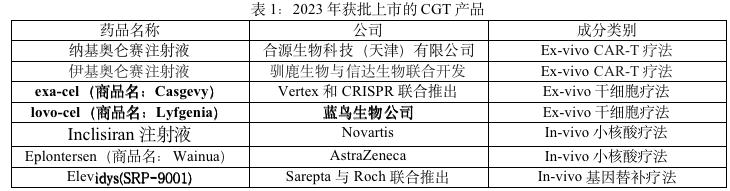
在全球范围内,2023年共有7款CGT产品迎来首次监管获批,创下新高。
值得一提的是,继FDA在2017年批准其首款基因疗法以来,该领域的获批数急速攀升,近三年更是迈入加速期,每年都有至少5款全新的细胞和基因疗法问世,较2017-2020年有大幅提升。
当下的细胞和基因疗法针对的主要还是癌症与罕见疾病。尽管在疾病方面和几年前的区别不大,但今年获批的细胞和基因疗法,依旧有着不少创新。
本文通过ex-vivo和in-vivo两个方面来详细介绍2023年基因治疗领域取得的最新进展。
ex-vivo CAR-T细胞疗法
首款具有中国全自主知识产权CD19 CAR-T细胞治疗产品问世
2023年11月08日,国家药品监督管理局(NMPA)已正式批准免疫细胞CAR-T治疗产品源瑞达®(纳基奥仑赛注射液CNCT19细胞注射液)的新药上市申请(NDA),用于治疗成人复发或难治性B细胞急性淋巴细胞白血病(r/r B-ALL)。纳基奥仑赛注射液由合源生物科技(天津)有限公司自主研发的靶向CD19 CAR-T细胞治疗产品,历时4年临床研究,具有全球独特的CD19 scFv(HI19a)结构和国际领先的生产制造工艺,在成人r/r B-ALL注册临床研究中生产成功率达到100%。
(图片1:来自国家药品监督管理局网站新闻)
ex-vivo CAR-T细胞疗法
全球首个全人源靶向BCMA CAR-T产品上市
2023年6月30日,驯鹿生物与信达生物联合开发的BCMA靶向CAR-T产品伊基奥仑赛注射液(曾用名:伊基仑赛注射液)已获批上市,用于治疗复发或难治性多发性骨髓瘤(MM)成人患者。根据临床研究(NCT05066646)结果分析,103例可评估患者中,总体缓解率(ORR)为96.1%,严格意义的完全缓解/完全缓解(sCR/CR)率为77.7%;91例既往无CAR-T治疗史的受试者中,ORR达98.9%,sCR/CR率达到 82.4%,12个月无进展生存(PFS)率为85.5%。总人群中微小残留病灶(MRD)阴性率94.2%,达到CR及以上患者MRD阴性率100%。中位达到MRD阴性时间15天,80.8%的患者在回输后12个月依然保持MRD阴性。此外,伊基奥仑赛注射液可以在体内较长期的存续,中位存续时间长达307.5天。
2023年12月21日FasTCAR-T GC012F治疗难治性系统性红斑狼疮的1/2期新药临床试验(IND)申请获中国NMPA正式批准;同年11月27日,亘喜生物宣布FasTCAR-T GC012F治疗难治性系统性红斑狼疮的1/2期新药临床试验(IND)申请获美国FDA正式批准。
GC012F是一款基于亘喜生物专有的FasTCAR次日生产平台开发的B细胞成熟抗原(BCMA)和CD19双靶点自体CAR-T候选产品。除了即将在中美启动的两项rSLE IND临床试验外,公司已在美国开展GC012F治疗复发/难治性多发性骨髓瘤(RRMM)的1b/2期IND临床试验;此外,还有4项IIT临床试验正在评估该疗法针对rSLE、RRMM、新确诊的多发性骨髓瘤(NDMM)以及B-NHL的临床效果。本月,GC012F治疗NDMM IIT临床试验的最新研究成果已在第65届美国血液学会年会上以口头报告形式公布,该临床数据显示总体应答率(ORR)为100%,微小残留病灶阴性的严格完全缓解率(MRD- sCR)为95.5%。
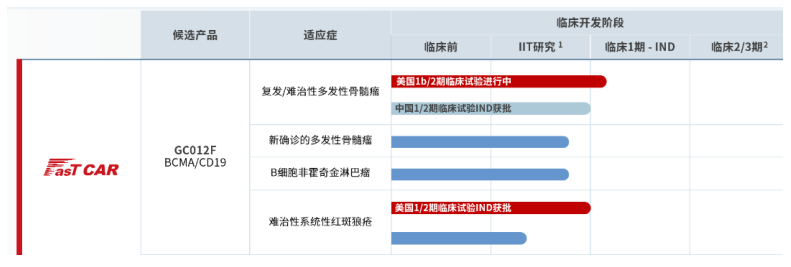
(图片2:来自亘喜生物官网https://www.gracellbio.com/pipeline/)
根据ClinicalTris官网数据,2023年进入临床研究的Car-T疗法共计215项,其中102项临床研究分布在国内(如图3)。
(图片3:丁香园insight数据库)
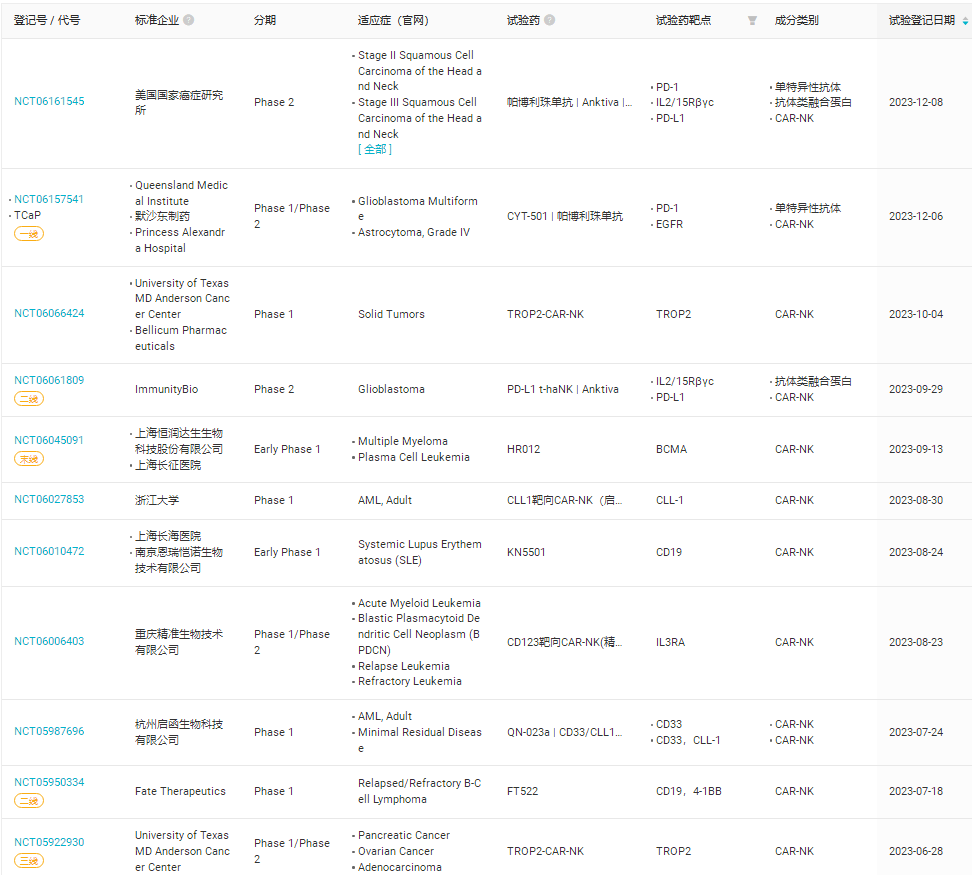
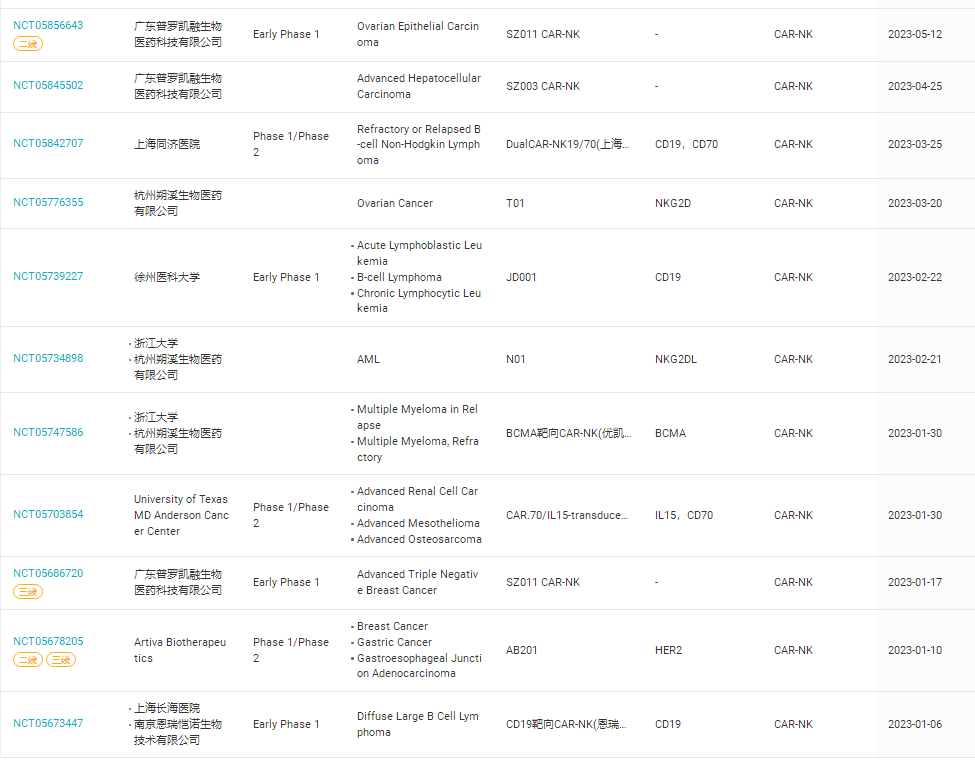
ex-vivo CAR-NK细胞疗法全球首个CAR-NK治疗红斑狼疮临床试验数据在中国诞生
针对复发难治的系统性红斑狼疮,利用独特的HTAS-RVTM递送系统和优异的NK细胞扩增和冻存制剂技术,南京恩瑞恺诺公司开发了国际领先的新一代“通用化”、“现货型”CAR-NK细胞治疗药物KN5501。 该药物通过靶向CD19来治疗复发/难治的系统性红斑狼疮,已完成4例重度系统性红斑狼疮患者的CAR-NK回输治疗。根据国际通行的SLEDAI-2K(轻度、中度、重度)三级病症评分标准,4名重度患者经该细胞治疗后,均实现了深度缓解,由“重度”转为“轻度”,并表现出相应的持久性。其中,2例重度患者经15天治疗即达到深度缓解,SLEDAI-2K疾病评分由14分和17分(重度病症)分别降至1分和3分(轻度病症),展现出非常积极的CAR-NK细胞治疗效果。
2023年除了KN5501外,还开展了22项CAR-NK相关的临床研究(表1),其中包括三款抗体联合给药。表1,2023年开展的关于CAR-NK临床研究(数据来自丁香园insight数据库)
ex-vivo 干细胞疗法
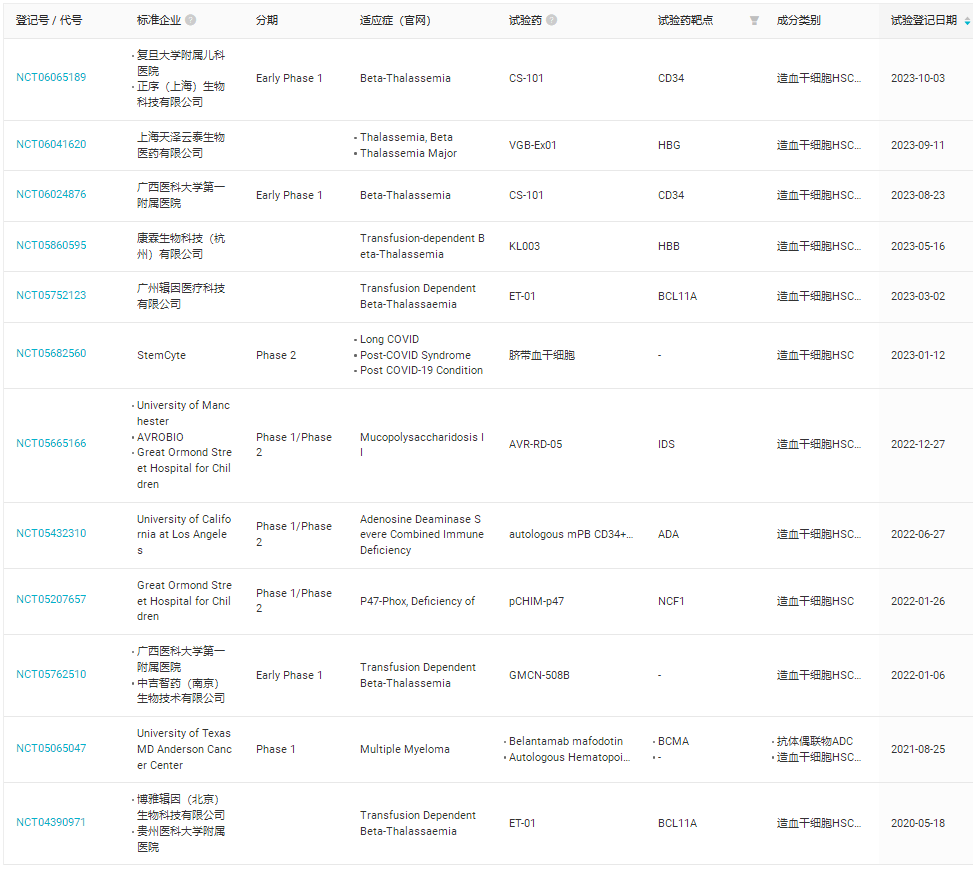
2023年,FDA批准两款干细胞基因疗法上市
2023年12月8日,FDA批准两款基因疗法上市,分别是Vertex和CRISPR联合推出的CRISPR/Cas9基因编辑疗法exa-cel(商品名:Casgevy)、蓝鸟生物的基因疗法lovo-cel(商品名:Lyfgenia),两款产品均用于治疗伴有复发性血管闭塞危象(VOC)的镰状细胞病(SCD)患者。
Casgevy是一款自体、体外CRISPR/Cas9基因编辑疗法,通过在体外对患者的造血干细胞进行改造,使红细胞可以产生高水平的胎儿血红蛋白。减少SCD患者的疼痛和血管闭塞性危象(VOC)。
Lovo-cel是一款基于慢病毒的用于治疗镰状细胞贫血病的自体干细胞疗法,通过慢病毒载体将具备功能的人βA-T87Q-珠蛋白基因拷贝至取自患者体内的造血干细胞中,再将这些干细胞回输到患者体内,使其自主生成β-珠蛋白,从而消除或大幅降低继续输血需求。
本年度全球范围内共开展了12项干细胞相关的临床研究(表2)。
表2,2023年开展干细胞疗法临床研究(数据来自丁香园insight数据库)
in-vivo基因增补疗法
基因增补疗法可以理解为通过载体将目的基因导入体内组织,表达功能完整的蛋白,从而补充替换功能异常的蛋白,达到基因治疗的目的。
Sarepta Therapeutics公司旗下的Elevidys是一款重组基因疗法的产品,该产品将表达微抗肌萎缩蛋白(micro-dystrophin)的基因包装在腺相关病毒载体(AAV)中,通过单次静脉注射,使得患者肌肉生成具有部分抗肌萎缩蛋白功能的重组蛋白,可以对携带任何类型DMD致病基因变异的患者生效。
2023年6月22日,Elevidys已经获得FDA的批准上市,用于治疗确认携带DMD基因突变,4-5岁的可行走DMD患者。
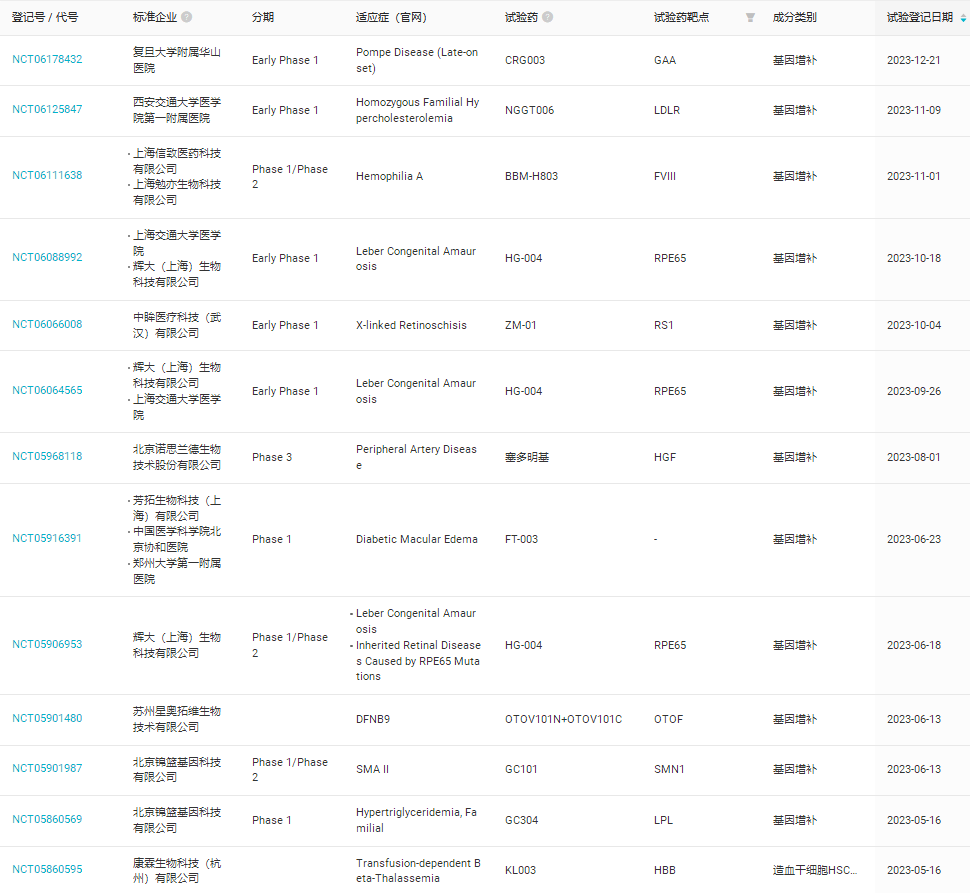
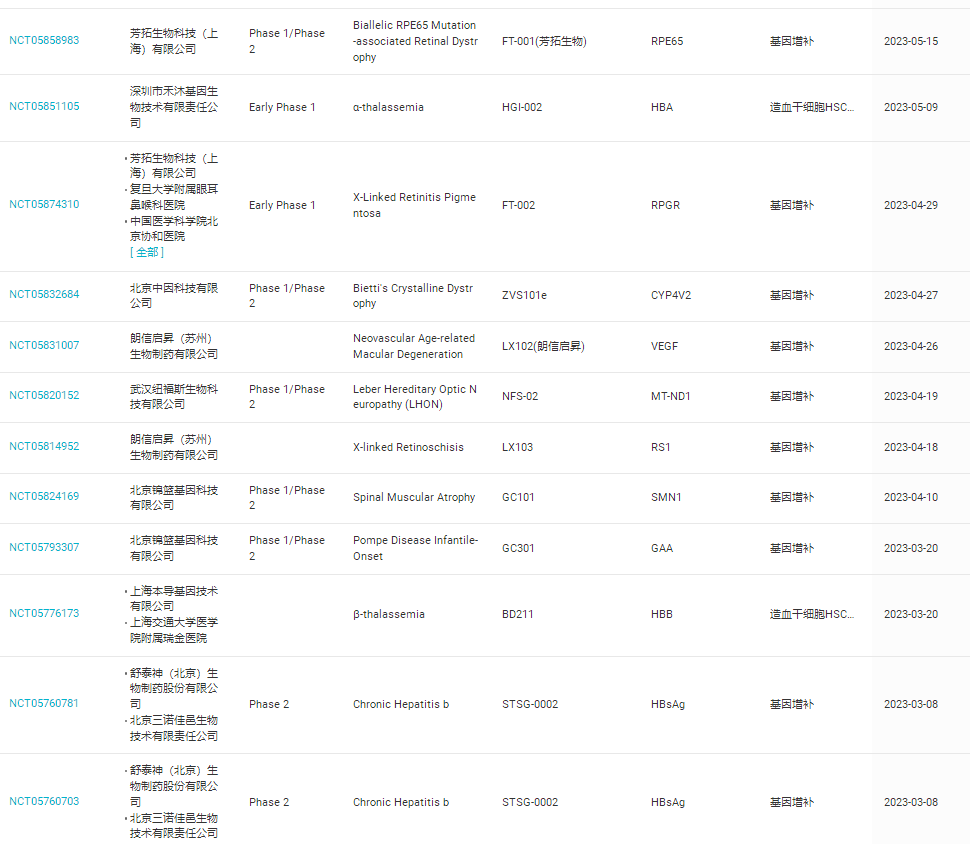
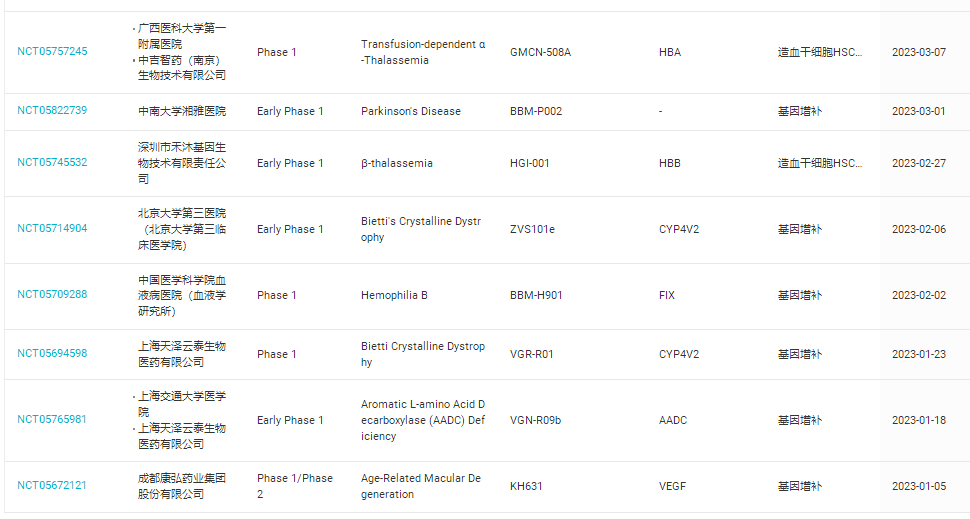
2023年期间,全球范围内开展了88项关于基因增补疗法的临床研究,仅在中国就有22项(如表3)
表3,2023年中国开展关于基因增补疗法的临床研究(数据来自丁香园insight数据库)
in-vivo CRISPR相关疗法
NTLA-2001于2023年底启动全球3期临床研究
IntelliaTherapeutics宣布NTLA-2001于2023年底启动全球3期临床研究,拟用于治疗转甲状腺素蛋白介导(ATTR)淀粉样变性心肌病。NTLA-2001是首个获准进入后期临床开发阶段的在研体内CRISPR基因编辑疗法。同年10月,欧洲药品监督管理局(EMA)授予NTLA2002用于治疗HAE优先药物审批资格。
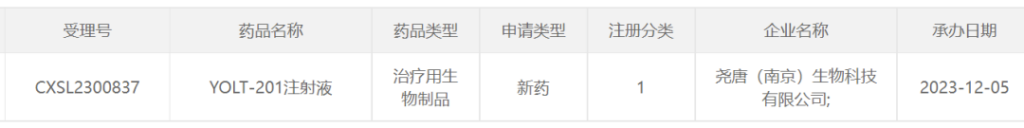
尧唐生物YOLT-201注射液
2023年12月5日,尧唐生物YOLT-201注射液的临床试验申请获得NMPA受理。YOLT-201为一款体内基因编辑疗法,采用mRNA-LNP递送系统,瞬时表达基因编辑工具,从而减少脱靶风险。其递送机制和靶点均与NTLA-2001一致,不同点在于尧唐生物开发了新一代剪辑编辑工具YOLBE。
本导基因的BD111
2023年2月4日,国家药品监督管理局药品审评中心同意受理本导基因提交的BD111眼用注射液临床试验申请。BD111是用于治疗单纯疱疹病毒型角膜炎(HSK)的基因编辑眼用注射液。该药物利用本导基因原创性递送技术VLP转导CRISPR基因编辑工具直接靶向切割单纯疱疹病毒(HSV-1)的基因组,达到清除HSV-1病毒基因组的目的,从而实现对疱疹病毒型角膜炎的治疗。
in-vivo RNA编辑疗法
WVE-006:首款进入临床试验的RNA编辑疗法
近日,Wave Life Sciences公司宣布,在研RNA编辑候选疗法WVE-006在Ⅰ期临床试验RestorAATion中开始给健康志愿者给药。这一疗法旨在用于治疗α-1抗胰蛋白酶缺乏症。新闻稿指出,这是首款进入临床试验的RNA编辑疗法。WVE-006是一款潜在“first-in-class”,GalNAc偶联的RNA编辑寡核苷酸,致力于恢复功能性、野生型α-1抗胰蛋白酶(AAT)蛋白的产生和循环,并降低突变Z-AAT蛋白的水平,以治疗与α-1抗蛋白酶缺乏症(AATD)相关的肺部或肝脏疾病。
in-vivo小核酸疗法
根据针对的小核酸类型,可以分为反义核酸(ASO)药物、小干扰核酸(siRNA)药物等。
2023年9月11日,CDE 官网显示,诺华(Inclisiran注射液)获批临床,用于原发性高胆固醇血症。该药是首个靶向 PCSK9 的 siRNA 药物。Inclisiran 是一种长效 RNAi 降脂药,将靶向 PCSK9 的双链 siRNA 与靶向肝细胞去唾液酸糖蛋白受体的 GalNAc 进行偶联,不仅使 siRNA 分子的稳定性得到了提高,同时可实现对肝脏的特异性递送。
2023年11月30日,石药集团发布公告称,集团自主研发的化学1类新药SYH2053注射液(双链小干扰RNA(siRNA)药物)已获得中华人民共和国国家药品监督管理局批准,可以在中国开展临床试验,SYH2053作用机制和靶点与Inclisiran类似。
2023年12月21日,阿斯利康宣布美国食品和药物管理局(FDA)已批准反义寡核苷酸(ASO)疗法Eplontersen(商品名:Wainua)上市,用于治疗成人遗传性转甲状腺素蛋白(TTR)介导的淀粉样变性的多发性神经病(ATTRv-PN)。