核酸药物行业发展现状及前景展望
来源:综合整理 | 发布时间:2023-09-05
摘要:核酸药物主要分为小核酸药物和mRNA两大类,小核酸药物,包括反义核酸(ASO)、小干扰核酸(siRNA)、微小RNA(miRNA)、核酸适配体(Aptamer)及其他。mRNA产品可分为mRNA疫苗和mRNA药物。
核酸药物主要分为小核酸药物和mRNA两大类,小核酸药物,即寡核苷酸药物,包括反义核酸(ASO)、小干扰核酸(siRNA)、微小RNA(miRNA)、核酸适配体(Aptamer)及其他。mRNA产品可分为mRNA疫苗和mRNA药物。
核酸药物将迎来快速发展期。基于核酸类技术的创新药研发是目前药物研发的重要赛道之一。Patisiran, Givlarri等药物的获批标志着小核酸药物新纪元的到来;mRNA疫苗类核酸品种的研发热度高涨催生产业大规模兴起。核酸药物靶点丰富、特异性强,能够从源头对疾病进行干预,在遗传疾病、肿瘤、病毒感染等疾病的治疗上有广泛的应用前景,有望成为继小分子药物和抗体药物后的第三大类药物。目前已有数十款核酸药物上市且取得积极的市场反馈,核酸药物进入高速发展期。
核酸药物是一种从基因转录后、蛋白质翻译前阶段进行调控的治疗方法。不同于传统的小分子或者单抗药物,核酸药物成分由特定序列的核苷酸构成,利用核酸分子的翻译或调控功能从疾病源头进行干预,与传统药物相比兼具“治标治本”功能。
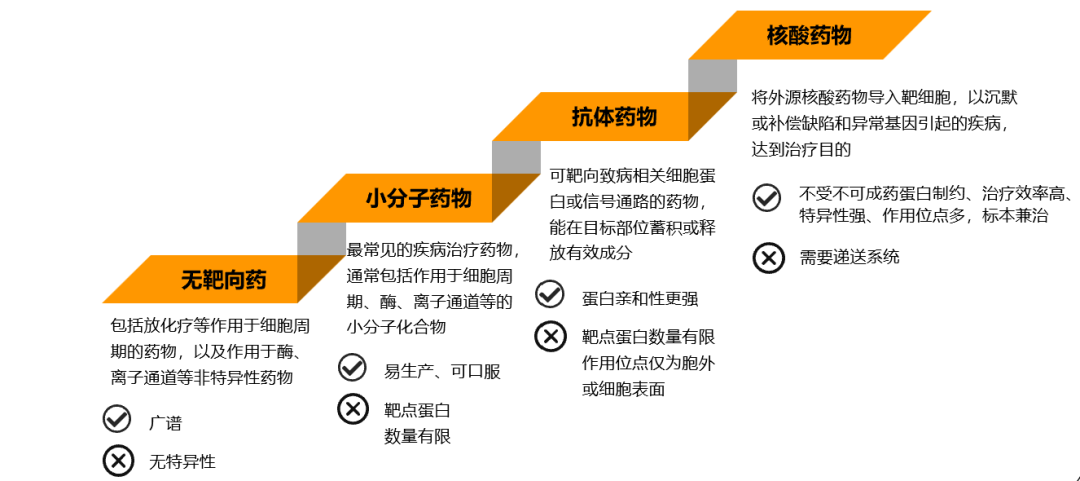
图:治疗药物演变趋势
数据来源:弗若斯特沙利文
一、核酸药物的发展历程
1978年,哈佛大学科学家发现用一段互补的核苷酸链可以抑制RSV病毒的复制活动,首次提出反义核酸(ASO)的概念。
1990年,Science和Nature分别报道了在体外筛选出可以与目标蛋白分子亲和力较强的RNA链,即RNA适配体(RNAaptamer)。
1998年,FDA批准了全球首款ASO药物Vitravene上市。
2006年,AndrewFire和CraigMello揭示的RNA干扰的作用机理(RNAi)获得了诺贝尔奖使核酸研究推上新的高峰,核酸药物也进入了震荡发现期。
2010年左右,由于RNAi的不稳定性及递送系统的缺乏,行业发展遭遇瓶颈。
2014年后,随着小核酸偶联递送系统GalNac的发展,极大地促进和推动了小核酸药物发展的快速复苏。
2016年后,多款重磅小核酸药物陆续上市,在遗传罕见病和慢性病等领域取得重大突破。
2018年全球首款siRNA药物获批上市,2020年年底首款信使RNA(messenger RNA,mRNA)疫苗获批上市,在过去两年为新冠疫情防控提供了最重要的武器。
截止2021年底,全球有超过50个ASO药物处于临床阶段,各大药企正通过自主研发或合作引进管线等方式积极布局小核酸药物领域。 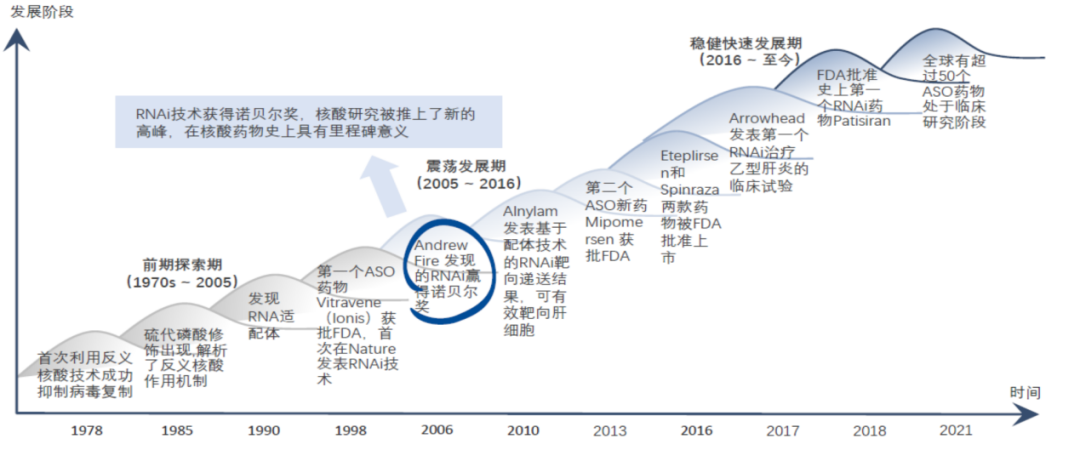
图:核酸药物的发展历程
数据来源:弗若斯特沙利文
截止2023年5月,目前有3款mRNA疫苗、5款siRNA药物和9款ASO药物获批。目前上市的14款药物适应症基本为罕见病;3款疫苗用来预防新型冠状病毒感染及重症。
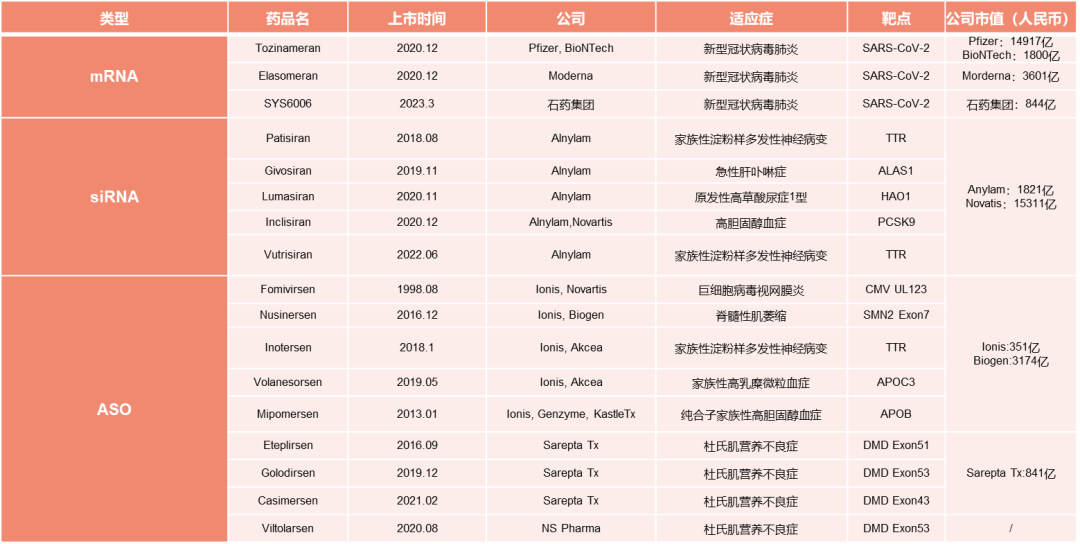
已上市药物总结 (截止2023年5月5日)
二、小核酸药物赛道解析
1.小核酸药物分类
小核酸药物可以主要分为反义寡核苷酸 (ASO)、小干扰RNA (siRNA)、微小RNA (miRNA)、小激活RNA (saRNA)、信使RNA (mRNA)、RNA适配体(Aptamer)等。
1.1反义寡核苷酸 (ASO)
ASO 是短合成核酸,使用经典的 Watson-Crick 碱基配对与细胞 RNA 杂交,以调节基因表达。通过结合前mRNA或mRNA,ASO可以通过修饰前mRNA加工和剪接、竞争性抑制、翻译机制的空间位阻和结合靶RNA降解等机制来调节蛋白质合成。
与前mRNA相互作用的能力使ASO能够靶向剪接过程,并显著增加可以选择用于ASO结合的RNA序列的数量,这也可以限制脱靶效应。ASO−RNA结合受到靶RNA和完整ASO分子之间的互补性的严格调节,其长度通常在13至30个核苷酸之间。这种严格的结合特异性与ASO功效直接相关,但如果确实发生脱靶结合,可能会加剧毒性。ASO核苷、核碱基和核苷间主链的化学修饰对于改善药代动力学和药效学,同时保持靶标亲和力和功效至关重要。
截至目前,市场上有7款ASO药物。药物化学的进步、对分子途径的理解以及大量遗传数据的可用性导致ASO药物的治疗性能有了巨大的改善;然而,它们对循环降解的敏感性、快速的肾脏清除和免疫刺激的不良反应极大地限制了它们的临床应用。越来越多的基于ASO的疗法正在临床试验中进行测试。ASO药物递送的改进可能会在不久的将来改变许多疾病的治疗格局。
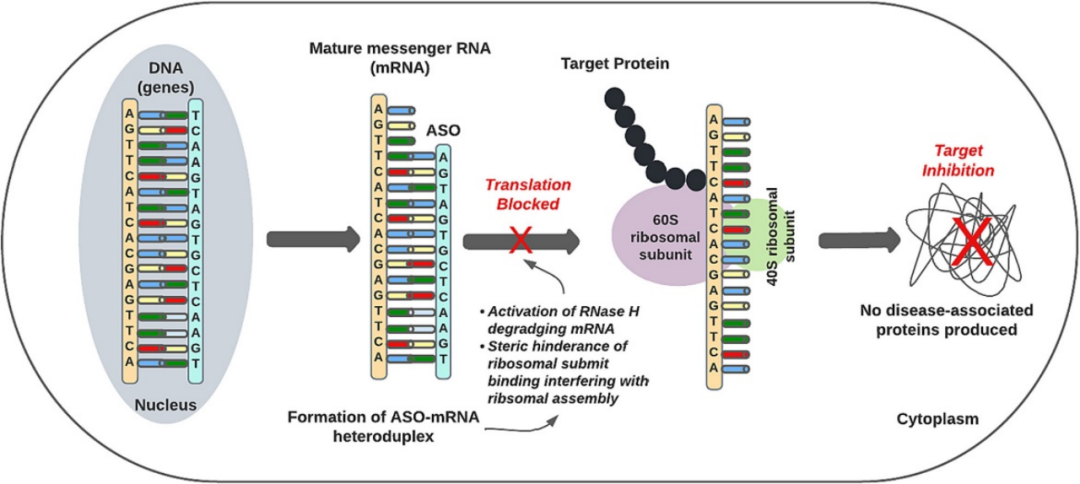
图:ASO作用机制
1.2小干扰RNA (siRNA)
RNA干扰(RNAi)是一种古老的生物机制,用于防御外部入侵。理论上,它可以以序列特异性的方式沉默任何与疾病相关的基因,使小干扰RNA(siRNA)成为一种有前途的治疗方式。在没有保护性递送载体的情况下,siRNA必须进行化学修饰,以确保肠胃外给药后循环的稳定性。
N-乙酰半乳糖胺(GalNAc)偶联是增加siRNA靶器官积累和促进其细胞摄取的有效方法。去唾液酸糖蛋白受体ASGPR特异性地将碳水化合物与末端半乳糖或GalNAc残基结合,配体结合后,受体-配体复合物被网格蛋白依赖性受体介导的内吞作用内化。ASGPR丰富(每个细胞约500,000个ASGPR)并且主要在肝细胞正弦膜上表达(占总表达的>95%),是肝siRNA递送的理想受体。此外,其高内化和再循环率(几分钟内)允许连续摄取siRNA分子,从而提高靶细胞浓度。选择性和高效的ASGPR靶向配体,优化的siRNA设计和有利的给药途径是临床翻译GalNAc−siRNA的关键因素。另外最初为ASO疗法设计的骨架化学进展也已应用于siRNA疗法。
最后,给药途径影响了GalNAc−siRNA偶联物的临床翻译并影响了患者的依从性。由于其低分子量,GalNAc−siRNA偶联物适合皮下给药,这延迟了siRNA递送到肝脏,但由于ASGPR的高容量回收,仍然可以实现高效和稳定的敲低。
经过二十年的发现,市场上已有5款siRNA药物,siRNA疗法目前已经树立了一个非凡的里程碑,因为它已经并将继续改变人类疾病的治疗和管理。它可以每季度一次,甚至每年两次给药,以达到治疗效果,而小分子和抗体则无法达到这种效果。
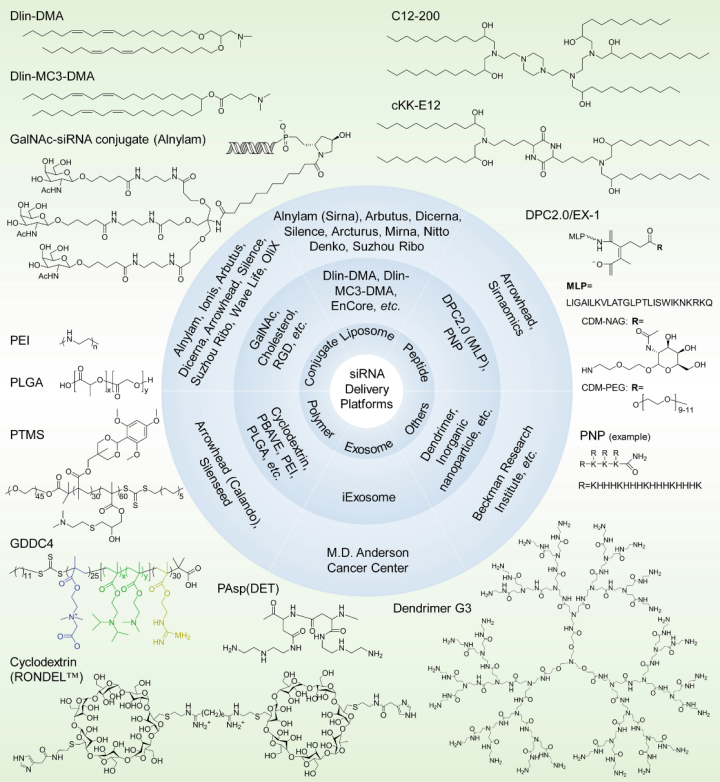
图:经过临床前和临床评估的siRNA递送平台
1.3微小RNA (miRNA)
MicroRNA (miRNA)是一类内生的、长度约为20-24个核苷酸的小RNA,其在细胞内具有多种重要的调节作用,miRNA的表达水平与多种肿瘤的发生、发展有着密切的关系
miRNA最早发现于1993年,此后该领域进展迅速,在各方向均取得了巨大成就。其主要的三位发现人,来自麻省大学医学院的Victor Ambros、麻省总医院的Gary Ruvkun以及英国哥伦比亚大学的David Baulcombe获得了2008年的拉斯克基础医学奖,并连续多年成为诺贝尔生理与医学奖的热门候选人。miRNA药物的研发策略包括导入可帮助下调疾病相关基因活力的miRNA分子和下调某些过高表达的疾病相关miRNA分子的功能两方面。以癌症为例, miRNA药物治疗包括两种方式:一是通过使用miRNA模拟物(miRNA mimics)补充具有抑癌功能的miRNA,二是通过miRNA抑制剂(miRNA inhibitors)来抑制促进癌症发生的miRNA。
尽管在推动治疗性miRNA的临床常规应用方面需要克服一些障碍,但这些障碍可以明确定义并具体解决。需要解决的重要问题包括如何确保正确的靶向,如何减少免疫原性反应,以及需要什么剂量才能达到预期效果,同时最大限度地减少副作用。已经有许多关于将治疗性miRNA施用到身体,在血液中保护递送,将miRNA定向到靶细胞,靶细胞有效摄取以及优化细胞中基因靶向的新方法或优化方法的研究,在短短20余年间,对miRNA的研究已从实验室进入到临床阶段,目前有很多成功的Ⅰ期临床试验以及正在开展的Ⅱ期临床试验,暂未有获批上市。
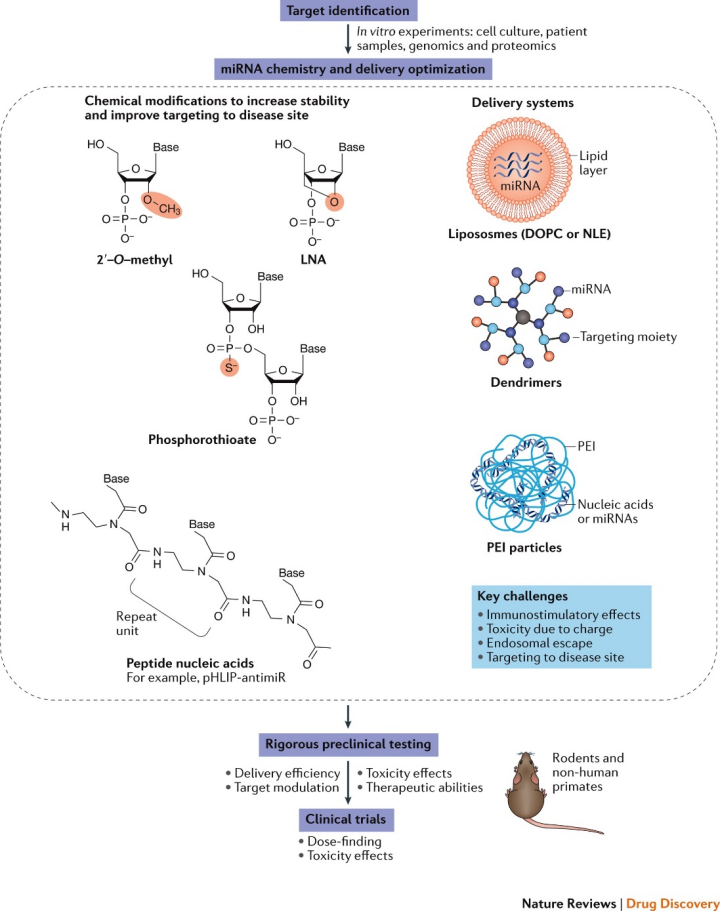
图:miRNA疗法开发的关键步骤
1.4小激活RNA (saRNA)
RNA激活(RNA activation,RNAa)是一种在转录水平激活目的基因表达的RNA调控方式,能够激活基因转录的小分子RNA被称为小激活RNA(small activating RNA,saRNA)。
saRNA是一种短的双链寡核苷酸,化学结构与小干扰RNA(siRNA)类似,但作用结果却相反,通过完全不同的RNA激活(RNAa)机制发挥作用。saRNA通过将内源性转录复合物招募到靶基因,导致mRNA的表达增加和靶蛋白的上调。
自2000年代中期发现以来,saRNA设计、合成化学和对生物学的理解的改进已经形成了成熟应用RNA的方式,MiNA Therapeutics已经为晚期肝细胞癌患者进行了首次saRNA临床试验,并取得了可喜的结果,暂未有获批上市。然而,为了充分实现saRNA的潜力,需要更好的saRNA递送策略来靶向其他疾病。目前,saRNA可以通过脂质纳米颗粒,树枝状聚合物,脂质和聚合物杂化物和适配体在体内递送。进一步发展这些递送技术和RNA的新应用将被证明对新的治疗方法开发具有不可估量的价值。
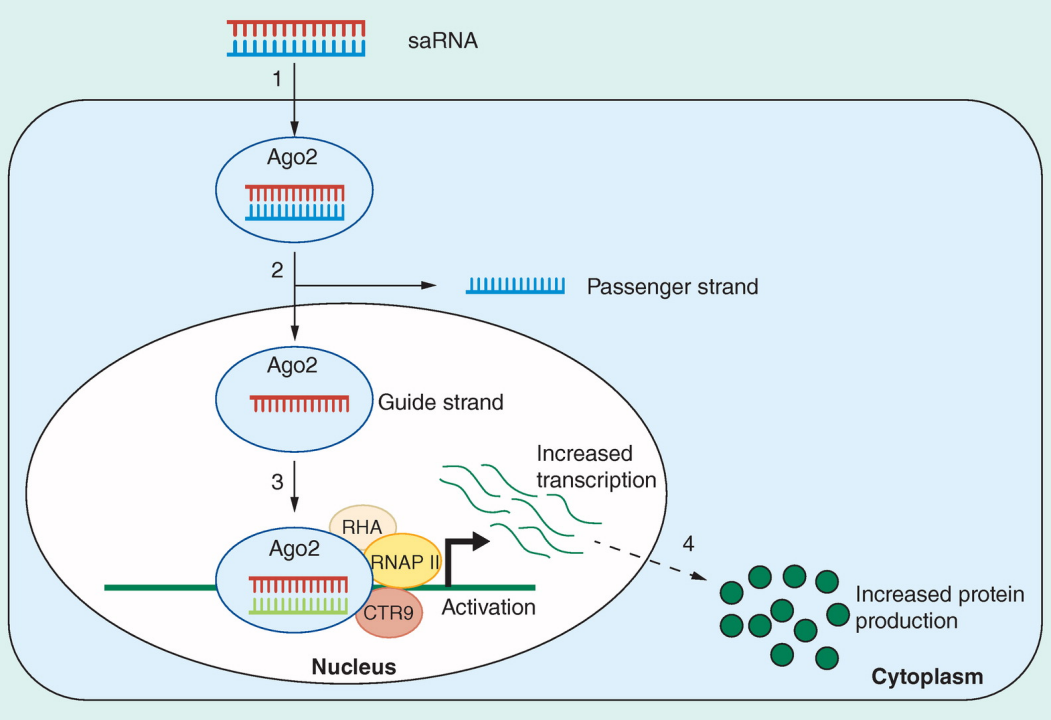
图:saRNA机制模型
1.5信使RNA (mRNA)
mRNA药物分为三个基本类别:预防性疫苗,治疗性疫苗和蛋白质编码疗法。尽管每种应用都有其独特的挑战,但所有应用面临的一个共同挑战是需要在保持mRNA稳定性的同时将mRNA部分在细胞内递送到靶细胞。RNA本质上是一种不稳定的分子,早期将mRNA药物的概念转化为现实的大部分工作都集中在稳定性上,为此使用了各种技术,包括优化 5′ 帽结构和 3′ poly(A) 尾长以及 5′ 和 3′ 非翻译区域内的调控元件。
除了在提高mRNA稳定性方面取得的这些进展外,有效的体内mRNA药物还需要有效的细胞内递送。十年的实验,从裸mRNA开始,然后探索mRNA缩合成纳米制剂,已经趋同于越来越关注脂质制剂以实现递送。mRNA的生物医学用途继续迅速发展,主要集中在三个领域:直接体内给予mRNA用于预防传染病的疫苗,针对癌症的治疗性mRNA疫苗和mRNA编码的免疫疗法。mRNA在基因治疗和蛋白质治疗之间占据着独特的利基市场,结合了两者的许多优点,同时解决了任何一种所面临的独特挑战。
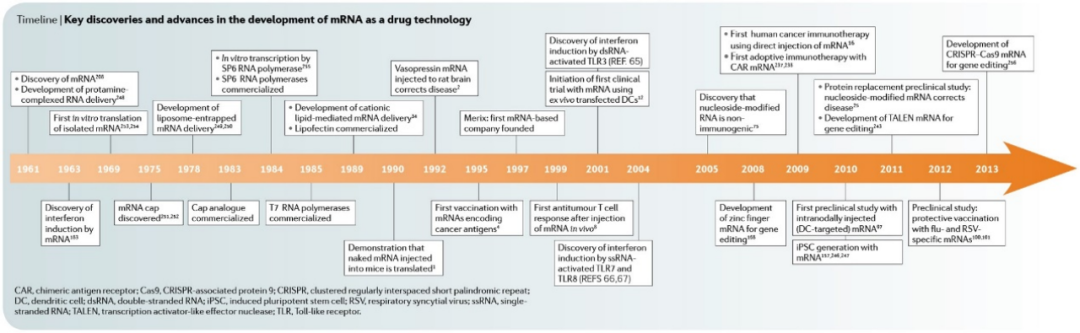
图:mRNA作为药物技术开发的主要发现和进展时间表
1.6RNA适配体(Aptamer)
RNA适配体(Aptamer)是单链RNA(ssRNA),具有独特三维构象,使它们能够与靶分子特异性结合。适配体可以相对容易地筛选、可重复制造、可编程设计和化学修饰,用于各种生物医学应用,包括靶向治疗。
适配体可以进行化学修饰以抵抗酶降解或优化其药理行为,从而确保其在生理条件下的化学完整性和生物利用度。作为一类分子配体,核酸适配体与其他类别的配体(如抗体或肽)相比具有一些特征,核酸适配体可以筛选多种分子靶标,包括难以产生抗体或通过噬菌体展示筛选肽的毒素或免疫原性差的靶标。适配体筛选高效(理想情况下可以在一周内)且具有成本效益。
核酸适配体已被探索用于广泛的生物医学应用。适配体介导的分子识别的高特异性需要应用它们来区分细微的分子差异,这在体外诊断(IVD)和诊断成像等情况下可能至关重要,用于患者分层以选择患者对某种靶向治疗的反应者。核酸适配体也被开发为治疗剂。
2.已上市小核酸药物
近年来FDA已批准了多款小核酸药物,主要用于治疗罕见病。截至2020年,全球累计超50个小核酸药物处于临床研究阶段,覆盖神经、心血管、感染和肿瘤等领域,共计有 15 款小核酸药物获批上市。但有2款早期ASO药物与1款适配体药物由于销售额过低等原因而退市,目前仍在市场的有7款ASO、5款siRNA药物。
这些药物的研发药企相对集中,大多是Ionis与Alnylam这两家公司。除此之外,目前上市的siRNA药物的递送系统多为GalNAc递送系统,这也是目前应用最成熟的小核酸递送方式。而第一款siRNA药物是使用了脂质纳米粒(LNP),由于LNP递送系统的构建拥有较高壁垒,目前全球发展靠前的几家企业,其技术溯源也都是依靠专利授权。
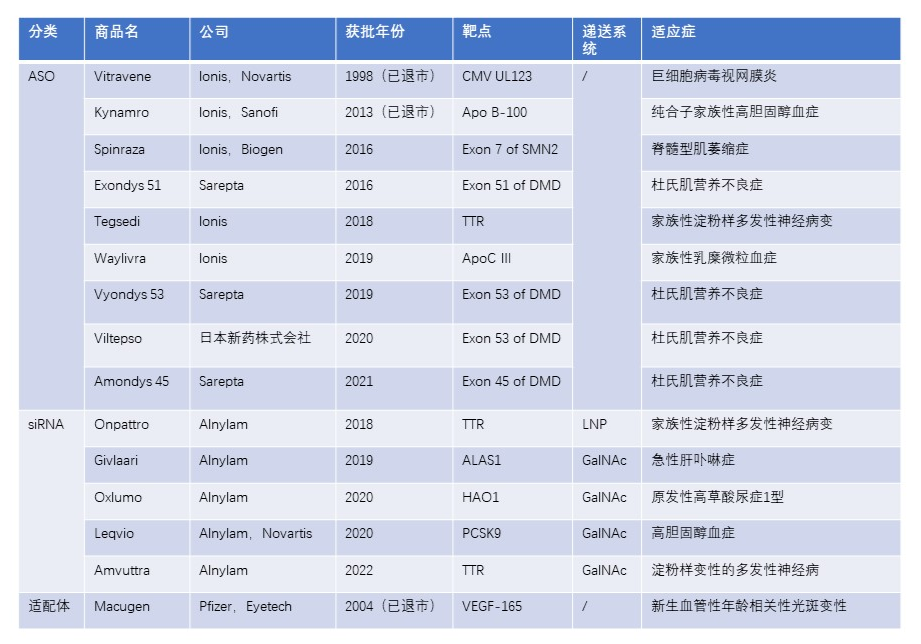
全球已上市小核酸药物
2.1Spinraza®(nusinersen)
Spinraza®(nusinersen;2016年)适用于治疗脊髓性肌萎缩症(SMA)的儿童和成人患者。脊髓性肌萎缩症(SMA)是一种致命的遗传性罕见病,是由运动神经元变性导致肌无力、肌萎缩的疾病。Spinraza®(nusinersen)是一种反义寡核苷酸(ASO),用于治疗由染色体5q突变引起的脊髓性肌萎缩症。染色体5q突变会导致生存运动神经元(SMN)蛋白出现缺陷。Spinraza®(nusinersen)能够阻止缺陷蛋白的合成,并促进完整SMN蛋白的产生,从而维持运动神经元的活性。2019年2月获批在中国上市,成为了国内第一个治疗SMA的药物。
2.2 EXONDYS 51®(Eteplirsen)
EXONDYS 51®(Eteplirsen;2016年)是第一款获批的使用PMO改造的反义寡核苷酸,用于治疗Duchenne肌营养不良症(duchenne muscular dystrophy,DMD),适用于已确诊DMD基因突变且适合外显子51跳过的患者,根据患者用EXONDYS 51®治疗后观察到的骨骼肌中肌营养不良蛋白增加而获得FDA的加速批准。DMD是由于基因缺陷使得肌肉细胞不能正常产生一种称为Dystrophin(肌营养不良蛋白)的蛋白质,从而引起全身性肌肉进行性退化。Eteplirsen通过与肌营养不良蛋白pre-mRNA的第51外显子结合,从而在mRNA加工过程中将该外显子排除在外,产生内部截短的肌营养不良蛋白并发挥作用。
2.3 Tegsedi®(inotersen)
Tegsedi®(inotersen;2018年)用于遗传性转甲状腺素蛋白淀粉样变性(hATTR)成人患者,治疗其第1阶段或第2阶段多发性神经病变。Tegsedi是一种反义寡核苷酸(ASO)药物,可抑制TTR蛋白(包括突变型和野生型)的生成。Tegsedi显示的临床益处与甲状腺素(TTR)蛋白的大量降低有关,这是hATTR淀粉样变性的内在病因。Tegsedi与血小板减少症和肾小球肾炎风险相关,需要加强监测以支持对这些风险的早期识别和管理。
2.4 Waylivra® (volanesorsen)
Waylivra® (volanesorsen;2019年)是一种用于治疗家族性乳糜微粒血症综合征(FCS)的药物,FCS是一种罕见的遗传性疾病,由脂蛋白脂肪酶(LPL)功能受损引起,患有FCS的患者可能出现严重的高甘油三酯血症(HTG)和甘油三酯(TG)诱发的胰腺炎风险升高。据估计,全世界约有3000-5000名FCS患者,其中欧洲约有1000名。Waylivra阻止载脂蛋白 C-III 的生产,可以减缓脂肪的分解,降低了血液中甘油三酯的水平,从而减少了体内脂肪的积累,这有望降低患胰腺炎的风险。
2.5 Vyondys 53®(Golodirsen)
Vyondys 53®(Golodirsen;2019年)由Sarepta Therapeutics研发,经美国FDA加速批准于2019年12月12日上市,用于治疗确诊为发生53外显子跳跃基因突变的杜氏肌营养不良症(DMD)的患者。
2.6 Viltepso®(viltolarsen)
2020年8月12日,FDA批准将Viltepso®(viltolarsen)注射剂用于可治疗的Duchenne肌营养不良(DMD)患者外显子53跳过治疗。由于肌营养不良蛋白的缺乏是DMD的根本原因,因此尽可能早地增加肌营养不良蛋白是DMD治疗的关键目标。Viltepso是第一个也是唯一的第53外显子跳过疗法,证明四岁以下儿童的肌营养不良蛋白增加。
2.7 Amondys 45®(casimersen)
2021年02月25日, Sarepta Therapeutics公司宣布美国FDA已批准该公司开发的反义寡核苷酸疗法Amondys 45®(casimersen)上市,用于治疗外显子45跳跃基因突变的杜氏肌营养不良症(DMD)患者。Amondys 45®成为继Exondys 51® (eteplirsen)和Vyondys 53® (golodirsen)之后,第3个在美国获批的 RNA外显子跳跃突变DMD的反义寡核苷酸疗法。
2.8 Onpattro® (patisiran)
2018年10月,Onpattro® (patisiran)获得FDA批准上市,用于治疗遗传性甲状腺素介导的淀粉样变性的多发性神经病。是首款siRNA药物及首个非病毒给药系统(LNP递送系统)的基因治疗药物。适应症为遗传性转甲状腺素蛋白淀粉样变性(hATTR)引起的周围多发性神经疾病,机制为沉默hATTR mRNA的表达,减少产生hTTR蛋白,逐渐减少周围神经中淀粉样沉积物(hTTR)的积累,最终达到治疗疾病的目的。临床给药途径为静脉输注,每3周1次。siRNA分子的分子量约为14kD,具有生物大分子结构特性。
2.9 Givlaari®(givosiran)
Alnylam公司的RNAi疗法Givlaari®(givosiran;2019年)用于治疗成人急性肝卟啉症(acute hepatic porpyria,AHP)患者。这也是继Onpattro®(patisiran)之后,第二款上市的RNAi新药。Givlaari®是一款皮下注射的RNAi药物,它能够靶向降解编码ALAS1蛋白的mRNA。ALAS1是合成ALA和PBG的重要蛋白酶,每月接受Givlaari®治疗能够显著持久地降低肝脏中ALAS1的水平,从而将具有神经毒性的ALA和PBG的水平降低到正常范围。
2.10 Oxlumo®(Lumasiran)
2020年11月23日,FDA批准Alnylam制药公司的RNAi疗法Oxlumo®(Lumasiran)作为首个治疗原发性高草酸尿1型(PH1)的药物,PH1是一种罕见的遗传性疾病。Oxlumo®获得孤儿药称号和突破性治疗指定。Oxlumo®是第一个被批准用于治疗PH1的药物,也是唯一一个被证明可以降低有害草酸水平的疗法。3期临床数据显示,Oxlumo®治疗显著减少了肝脏中草酸的生成,这可能解决PH1的内在病理生理学问题。
2.11 Leqvio®(inclisiran)
2020年12月11日,Novartis Pharma GmbH诺华制药公司宣布欧盟已经正式批准该公司的Leqvio®(inclisiran),作为饮食控制的一种辅助手段,用于治疗成人原发性高胆固醇血症(杂合子家族性和非家族性)或混合型血脂异常,Leqvio® 成为了全球第一个也是唯一一个小干扰RNA(siRNA)降胆固醇(LDL-C)疗法;是一款全球首批的“first-in-class”的治疗药物,因此具有里程碑意义。
2.12 Amvuttra®(vutrisiran)
2022年6月14日,Alnylam宣布,FDA批准其RNAi药品Amvuttra®(vutrisiran)用于治疗成人遗传性转甲状腺素介导(hATTR)淀粉样变性的多发性神经病。hATTR淀粉样变性是一种罕见的、遗传性的、进展迅速的致命疾病,有多发性神经病表现,治疗方法很少。Amvuttra每三个月皮下注射一次,Alnylam公司2018年获批的Patisiran需要每三周皮下注射一次。
三、mRNA赛道解析
1. mRNA+疫苗
巨头必争之地,竞争态势已发
相较于传统的预防性疫苗,虽然都是通过体液免疫实现保护性效果,但mRNA的优势在于其强大的免疫激活能力、自佐剂能力以及灵活的设计与生产流程。目前仍有很多传染性疾病缺乏有效的预防手段,包括艾滋病病毒1型(HIV-1)、单纯疱疹病毒(HSV)和呼吸道合胞病毒(RSV)等。另外,那些迅速出现、致死率高的急性病毒性疾病也需要更加快速、通用的疫苗开发平台。
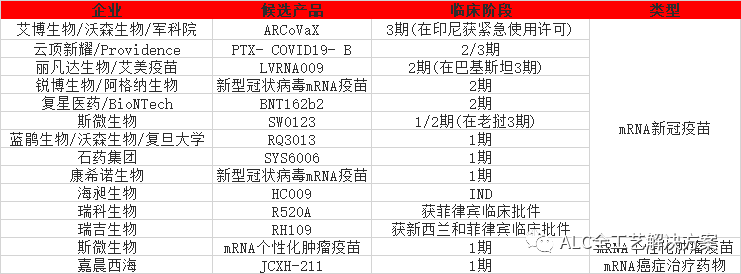
国内临床在研mRNA疫苗管线
近一年来,mRNA疫苗已经在多个传染病预防领域取得了重大进展:
- 2022年1月,Moderna和IAVI在实验性HIV疫苗抗原的临床试验中进行了第一次注射,5月在非洲开始了mRNA HIV疫苗mRNA-1644的1期临床试验;
- 2022年12月,BioNTech启动了预防性单纯疱疹病毒2型(HSV-2)的mRNA候选疫苗BNT163的1期临床试验;
- 2023年1月18日,Moderna宣布,其靶向呼吸道合胞病毒(RSV)的mRNA疫苗mRNA-1345在3期临床试验中达到主要终点,将计划在今年提交上市申请;但是其四价流感疫苗的3期临床数据却是喜忧参半。
预防传染性疾病绝不是mRNA的全部使命,用mRNA技术攻克肿瘤才是各大巨头接下来的主战场。mRNA在肿瘤抗原选择上具有其独到优势,它能够编码多个甚至数十个抗原,并且可将细胞因子等调节蛋白共同编码,这对于应对实体肿瘤的异质性与微环境抑制无疑是一项强有力的武器。
- BioNTech公司创始人去年接受采访时表示,预计其mRNA肿瘤疫苗将在2030年之前上市,公司在去年的ESCO年会上公布了其CAR-T+CARVac(表达抗原Claudin 6的mRNA疫苗)联合治疗Claudin6阳性实体瘤1/2期临床的初步数据,客观缓解率为33%,疾病控制率达到了67%;
- 2022年12月13日,Moderna也公布了其个性化mRNA肿瘤疫苗mRNA-4157在2b期临床试验中与默沙东Keytruda联合给药的数据,结果显示,这一联合疗法将晚期黑色素瘤患者的复发或死亡风险降低了44%。而这款mRNA疫苗可编码多达34种新生抗原。
2.mRNA+细胞疗法
强强联手,解锁通用细胞新范式
随着研究的深入以及新技术的不断迭代发展,CAR-T疗法成本高、耗时长以及可及性低的短板也逐渐有了多种解决方案,其中之一就是使用靶向性的递送系统将mRNA编码的CAR结构基因送至目标组织,实现体内生成CAR-T细胞。
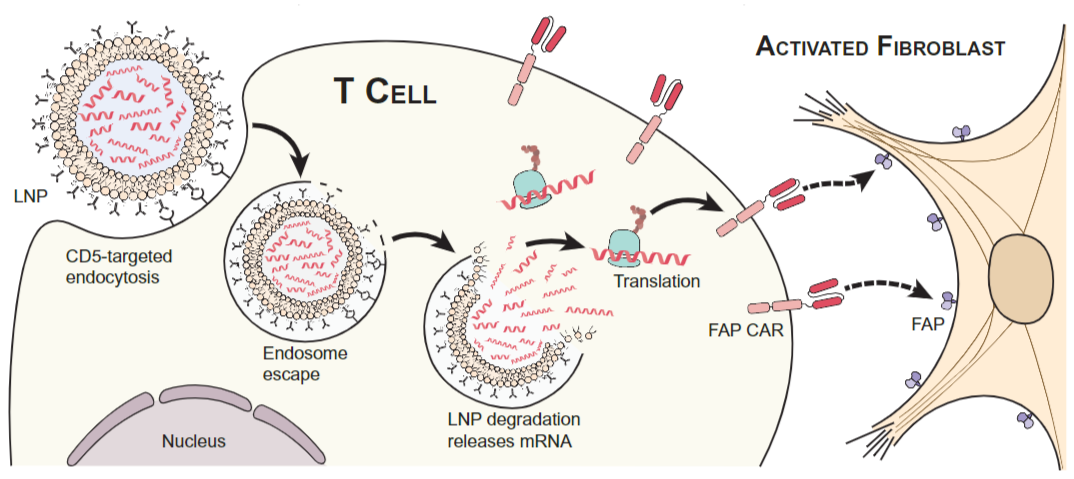 图:mRNA体内生成CAR-T原理
图:mRNA体内生成CAR-T原理
目前可用于递送编码CAR基因mRNA的递送载体有很多种,其中,纳米制剂可以在体内递送至多种类型的免疫细胞,在mRNA与免疫细胞疗法的结合中极具前景。去年年初,在一篇发表在Science的文章中,研究人员通过LNP递送mRNA成功实现了T细胞的重编程,成功研发出在体内生成的、瞬时工程化 CAR-T 细胞疗法。国内远泰生物、优卡迪、济因生物、先博生物等公司已经在mRNA-LNP体内制备CAR-T/NK这一领域有所布局,并已经取得了实质的进展。
3.mRNA+基因编辑
加速体内编辑可行性
mRNA可以提供基因编辑工具的瞬时表达,LNP的装载量也有较大的延伸空间,这给体内基因编辑的实现开启了新的机遇。相较于病毒递送载体,LNP-mRNA系统的瞬时表达使得脱靶风险更小,免疫原性更低,同时可以避免病毒元件可能随机整合进基因组的风险,展现出了极大的应用前景,目前已经在临床前和临床试验中获得应用,mRNA巨头Moderna也正积极布局于此。
- 早在2021年11月,Moderna与宏基因组学公司Metagenomi达成战略合作,今年2月22日,Moderna又与Life Edit Therapeutics达成合作,以开发体内mRNA基因编辑疗法;
- 2022年年初,辉瑞也与基因编辑领域的头部企业Beam Therapeutics达成合作,利用其在mRNA/LNP方面的优势,共同推进肝脏、肌肉和中枢神经系统的罕见遗传疾病的体内碱基编辑疗法。
- Intellia公司和再生元制药公司合作在研的NTLA-2001同样使用LNP进行递送,将靶向TTR基因的sgRNA与编码Cas9蛋白的mRNA递送到患者体内,特异性敲除肝细胞内的TTR基因,进一步实现转甲状腺素蛋白淀粉样变性(ATTR)的治疗。该疗法目前已进入1期临床,是mRNA-LNP技术向基因编辑领域渗透的最好案例。
4.mRNA+蛋白替代疗法
产量需求极高的蓝海
mRNA也可以通过直接编码免疫调节蛋白(如细胞因子)、酶等功能蛋白来实现治疗目的。目前,蛋白替代疗法被广泛用于多种罕见疾病治疗,比如用凝血因子VIII、IX分别治疗A型和B型血友病,用外源酶治疗一系列溶酶体贮积症。但是这些蛋白质的天然来源非常有限,而通过人工合成重组蛋白也面临着复杂的生产工艺,技术门槛与成本极高,并且这些大分子往往无法穿过血脑屏障。mRNA的跨界或许将为这一疗法带来新机。
相较于疫苗而言,作为蛋白替代疗法,需要在体内表达的蛋白量更高,也可能需要在特定组织中完成翻译后修饰来获得完整功能,因此目前还面临着翻译效率以及递送等方面的挑战,阿斯利康/Moderna、BioNtech、Arcturus therapeutics等巨头已经率先在该方向布局。
- Moderna的mRNA-3927已经进入2期临床试验。这款疗法通过编码线粒体酶丙酰辅酶 A 羧化酶(PCC)的α和β亚基,经由脂质纳米颗粒递送进患者体内,尝试使机体恢复PCC酶表达功能,以治疗丙酸血症。截至目前,mRNA-3927表现出了良好的耐受性,未发现剂量限制性毒性和药物相关严重不良事件。
5.mRNA+抗体
迭代成熟市场,先驱已行
mRNA的加入为抗体药物的开发也带来了新思路,首先,通过mRNA在体内表达抗体可延长其半衰期;其次,通过合适的递送系统进行靶向递送,可特异性地在目标组织或器官中实现精准分泌,降低毒副作用。
目前,已经有mRNA编码抗体的候选药物进入了临床阶段。
- BioNtech治疗Claudin18.2阳性实体瘤的BNT141正在进行1/2期临床试验,可在患者体内编码分泌型的IgG抗体;
- Moderna编码单克隆抗体的mRNA-1944同样在进行1期临床试验,适应症为基孔肯雅病毒。其首项基于健康受试者的临床试验数据表明,在所有试验剂量中均检测到了中和抗体;
与此同时,还有不少企业正在通过合作的方式入局这一赛道,例如,Neurimmune和Ethirs合作共研编码单抗、治疗新冠的吸入式mRNA药物;CureVac正和Cenmab合作开展一项基于编码单抗来治疗肿瘤的mRNA疗法。
6.mRNA+免疫刺激蛋白
促进下一代细胞因子药物开发
细胞因子这类小分子蛋白质作为治疗药物目前仍受到半衰期短、作用广泛与多效、易导致严重的不良反应等问题限制,因此至今仅有两款相关产品获批上市用于肿瘤治疗。通过LNP-mRNA系统靶向性、瞬时性、组合协同等优势,可有效降低细胞因子等免疫刺激蛋白直接给药治疗带来的副作用。目前,已有企业利用mRNA编码OX40L等共刺激分子、IL等细胞因子之类具有直接治疗效果蛋白的基因用于临床开发。
- mRNA-2416是Moderna一款LNP包裹的编码人OX40L的mRNA药物,适应症包括复发/难治性恶性实体瘤、淋巴瘤和卵巢癌,目前计划进行与单抗联合给药治疗卵巢癌的2期临床;另一款mRNA-2752则可编码OX40L、IL23和IL36g三种免疫调节因子,从2021年12月公布的数据来看,在联合给药中显示出了良好的耐受性和抗肿瘤活性;
- 嘉晨西海的JCXH-211是全球首款表达细胞因子IL-12的自复制mRNA药物,已先后获得FDA和CDE的临床试验许可,拟用于治疗恶性实体瘤。
四、国内外核酸药物代表企业
为了更直观的了解核酸药物国内外公司发展现状,我们在梳理了国内外核酸药物代表企业。
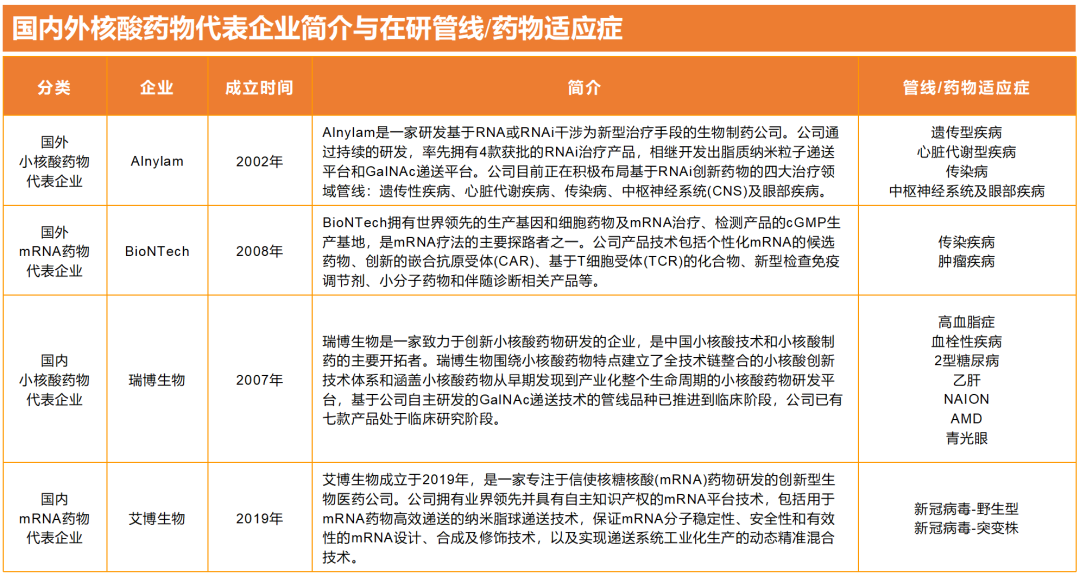
图:国内外核酸药物代表企业简介与在研管线/药物适应症
数据来源:公司官网
五、核酸药物行业未来可期
在对抗疾病的历史进程中,传统药物将蛋白质作为药物靶点。然而,人体内许多“致病蛋白质”为不可成药靶点,许多疾病缺乏有效的治疗手段。为了解决这一问题,人们沿着中心法则,利用核酸分子的翻译或调控功能,开发了核酸药物,以解决“不可成药”靶点带来的未被满足的临床需求。近年来,多款重磅核酸药物相继问世,在治疗代谢性疾病和预防传染性疾病方面展现出前所未有的应用价值。新冠疫情使核酸药物获得了大众的广泛关注,并带来了核酸药物的迅速发展,逐渐成为生物医药投资的重点以及医药企业研发的热点。
近年来,小核酸药物因特异性强、设计简便、研发周期短、靶点丰富、转化基础丰厚等优点,成为当前生物医药领域研究的重点。小核酸药物已有多款药物实现商业化发展,未来小核酸药物市场依然具有良好的前景。凭借小核酸独特的作用机制,其在众多适应证中拥有更大的开发潜力和临床价值。临床在研管线中不乏针对癌症、糖尿病、乙肝等大病种的临床试验,这将极大地弥补商业化重磅品种乏力的现状,支持小核酸药物市场未来的发展。
目前,mRNA技术在预防性疫苗应用上较为突出,其开发速度快,应对突发性流行病学危机优势明显,同时产能爬坡速度极快,批次产量可以达到亿剂。与传统疫苗相比,mRNA疫苗具有优异的免疫激活能力,通过内源性表达抗原蛋白,可以诱导更为广泛有效的细胞免疫及体液免疫反应,产生更高的保护率。数亿剂mRNA新冠疫苗的接种,验证了mRNA技术的安全性和效力。mRNA技术优势明显,将成为新型疫苗开发的重要选择,也有望拓展到肿瘤治疗、再生医学等更广阔的治疗领域。近年来,随着mRNA体外合成与递送技术的不断成熟,mRNA药物的稳定性和翻译效率大幅提高,mRNA技术得以快速发展。同时,在大量生物技术公司涌现、资本市场投融资热潮等因素推动下,未来mRNA药物市场将迎来高速发展。