制药巨头2024年展望:值得期待的里程碑事件
来源:医药魔方 | 发布时间:2024-02-21
摘要:跨国大药企2023年的财报陆续披露,对外展示了亮眼的业绩,重磅炸弹令人眼花缭乱,销售额百亿美元的分子似乎也不再稀缺。除了汇总各产品的全年销售表现,各家药企也会在财报中公布对未来业绩的展望,为下一年的发展定下基调。其中也包括2024年值得期待的里程碑事件,给足了大众预期。
跨国大药企2023年的财报陆续披露,对外展示了亮眼的业绩,重磅炸弹令人眼花缭乱,销售额百亿美元的分子似乎也不再稀缺。除了汇总各产品的全年销售表现,各家药企也会在财报中公布对未来业绩的展望,为下一年的发展定下基调。其中也包括2024年值得期待的里程碑事件,给足了大众预期。悄然中,新一轮竞赛已经打响。
2024年制药巨头值得期待的里程碑事件

罗氏:TIGIT迎来“生死”考验
2024年,罗氏迎来开门红,其重磅阵发性睡眠性血红蛋白尿症(PNH)新药可伐利单抗(crovalimab)2月在中国首发上市。这次获批意义重大,标志着罗氏第一次在中国市场实现一款创新药物的全球首发。可伐利单抗还在继续扩张其全球版图,罗氏预期其将于今年在欧美获批上市。多发性硬化症药物Ocrevus(奥瑞利珠单抗)多年稳坐罗氏头牌,2023年销售额达63.81亿瑞士法郎,占据24%的全球患者份额。罗氏正在尝试打通每年两次、每次10分钟的Ocrevus皮下制剂的上市之路以进一步攻占市场,欧美地区的患者有希望在2024年迎来这一新治疗选择。阿来替尼也有望在欧美地区扩展新适应症,辅助治疗ALK阳性NSCLC。罗氏也在中国申报了该适应症上市,并被CDE纳入优先审评。2023年9月,III期ALINA研究告捷,阿来替尼成为了首个也是唯一一个在III期试验中证明可降低ALK阳性早期NSCLC患者疾病复发或死亡风险的ALK抑制剂。研发进展方面,tiragolumab联合阿替利珠单抗一线治疗PD-L1高表达NSCLC的III期SKYSCRAPER-01研究预计将于2024H2读出最终总生存期 (OS)数据,可谓万众期待。这不仅可能决定tiragolumab的命运,也将会影响整个TIGIT赛道。

SKYSCRAPER-01研究充满反转。2022年5月,罗氏公布SKYSCRAPER-01研究的第一次中期分析数据,当时的结果显示研究未达到无进展生存期(PFS)主要终点,而另一个主要终点OS数据尚未成熟。PFS终点的失利,使业界对OS终点也不抱有太高的期望。2023年8月,KYSCRAPER-01研究第二次中期分析结果出炉,tiragolumab联合组的中位OS估计为22.9个月,阿替利珠单抗单药治疗组的中位OS估计为16.7个月,联合治疗相比单药治疗将死亡风险降低了19%。这次的积极数据又提振了布局玩家的信心。最终的OS结果如何,我们拭目以待。
阿斯利康:肺癌领域攻城略地
阿斯利康已经兑现了日程表里的两大里程碑事件。基于III期Flaura2研究,奥希替尼一线治疗EGFR突变NSCLC的新适应症已获FDA批准;其用于不可切除EGFR突变NSCLC的III期LAURA研究也显示出压倒性的PFS获益,有希望为III期EGFR突变NSCLC患者提供首个靶向疗法。2024H2,III期NeoADAURA研究也将公布结果,该研究旨在评估奥希替尼治疗II-III期可切除EGFR突变NSCLC患者的疗效。阿斯利康致力于成为肺癌领域的领导者,并立下雄心壮志——力争到2030年,阿斯利康的产品能够覆盖50%以上的肺癌患者。围绕这一目标,阿斯利康通过奥希替尼、度伐利尤单抗和德曲妥珠单抗这般的重量级产品打稳地基,TROP2 ADC药物Dato-DXd、PD1/CTLA4双抗volrustomig和EGFR/C-Met双靶点ADC AZD9592等新药进一步迭代布局。
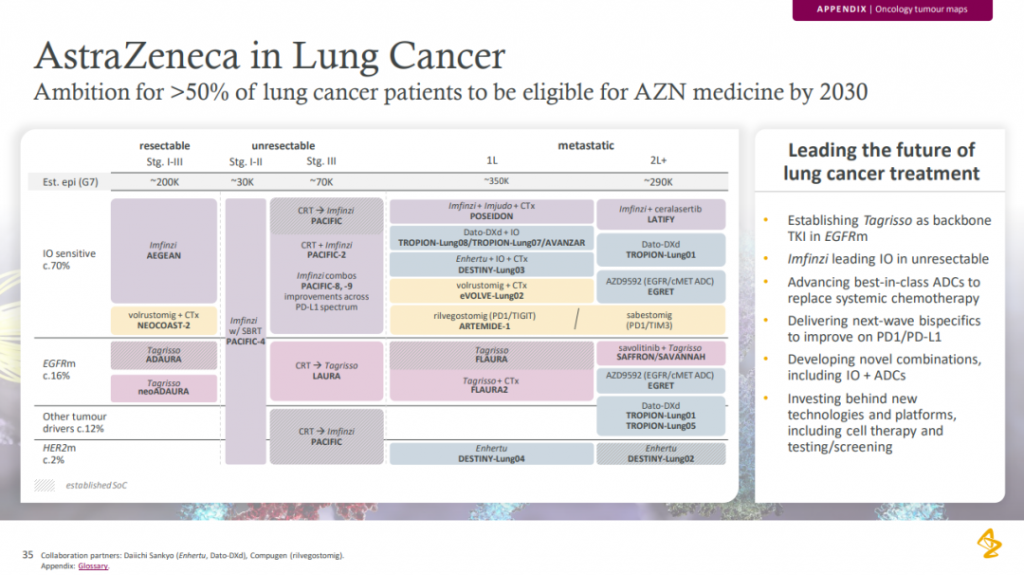
2024年的计划表里,阿斯利康还有望迎来度伐利尤单抗新辅助治疗II-III期NSCLC的新适应症扩展,针对局限期小细胞肺癌(SCLC)的III期ADRIATIC研究将于上半年公布结果,主要聚焦中国III期不可切除NSCLC患者的PACIFIC-5研究也将于下半年进行读数。除了肺癌领域,度伐利尤单抗一线治疗膀胱癌和辅助治疗肝癌的两项关键III期研究也将在今年揭晓结局。近日,阿斯利康和第一三共联合开发的Dato-DXd也在美申报上市,适应症为既往接受过全身治疗的局部晚期或转移性非鳞状NSCLC成人患者,PDUFA日期为2024Q4。如果获得批准,Dato-DXd将成为全球首个治疗肺癌的TROP2 ADC。此外,Dato-DXd一线治疗三阴性乳腺癌的III期TROPION-Breast02研究预计于2024H2撞线。阿斯利康和第一三共合作的另一款产品德曲妥珠单抗也将继续演绎传奇,在今年有望实现的重大突破包括:1)基于DESTINY-PanTumour02研究,H1在美获批治疗不可切除或转移性HER2表达实体瘤新适应症;2)基于DESTINY-Gastric01研究,H2在中国获批三线治疗HER2阳性/HER2低表达胃癌;3)二线治疗HER2低表达乳腺癌的III期DESTINY-Breast06研究的数据将于H1出炉。中国一直是阿斯利康全球第二大市场。罗沙司他是阿斯利康深耕中国市场的重要证明,它于2018年率先在中国获批上市,成为第一款MNC研发、在中国实现首发的新药。2024年,罗沙司他有望在中国进一步扩大适用范围,用于治疗化疗引起的贫血。IL-5Rα单抗本瑞利珠单抗也有希望在今年凭借MIRACLE研究进入中国市场。
诺华:打出肾病领域的关键球
诺华将在肾病领域打出关键手牌,其FIC口服补体B因子抑制剂iptacopan将于2024H1在美申报两项适应症,分别用于C3肾小球病和IgA肾病。分别来看,C3肾小球病是一种罕见的进行性补体介导的肾脏疾病,多见于儿童和年轻人。每年,全球每百万人中约有1-2人被新诊断为C3G。然而,目前尚无针对C3肾小球病的获批疗法。2023年12月,iptacopan治疗C3肾小球病的III期APPEAR-C3G研究已达到主要终点。

IgA肾病是全球慢性肾病和肾衰竭的主要原因之一,发病人群主要为青壮年。据估计,全世界每年每百万人中约有25人被新诊断为IgA肾病。值得注意的是,中国是全球IgAN发病率最高的国家之一。2023年10月,III期APPLAUSE-IgAN研究在中期分析中取得积极结果,iptacopan在减少IgA肾病患者的蛋白尿方面优于安慰剂。瞄准IgA肾病领域,诺华不止布局了一款产品。ETA拮抗剂atrasentan的III期ALIGN研究也收获成功。基于此,诺华将在2024H1递交该产品的上市申请。

自免领域,remibrutinib以III期REMIX-1和REMIX-2研究的积极结果在BTK赛道赢得差异化优势,这两项研究充分证实了remibrutinib治疗慢性自发性荨麻疹(CSU)患者的治疗潜力。诺华乘胜追击,准备于下半年在美日欧递交其上市申请。如若获批,remibrutinib将成为奥马珠单抗治疗CSU的有力补充。肿瘤领域,CDK4/6抑制剂瑞波西利有望实现新突破,或将在欧美地区获批辅助治疗HR阳性、HER2阴性早期乳腺癌的新适应症。2023年,瑞波西利营收20.80亿美元,同比增长75%。放射性配体疗法Pluvicto的销售表现也十分亮眼,增速达261%,距离10亿美元大关只差一步之遥。诺华预计于2024H2在美国申报其新适应症,用于未接受紫杉烷类化疗的转移性去势抵抗性前列腺癌(mCRPC);并将启动其针对寡转移性前列腺癌的III期研究。
礼来:donanemab与替尔泊肽双管齐下
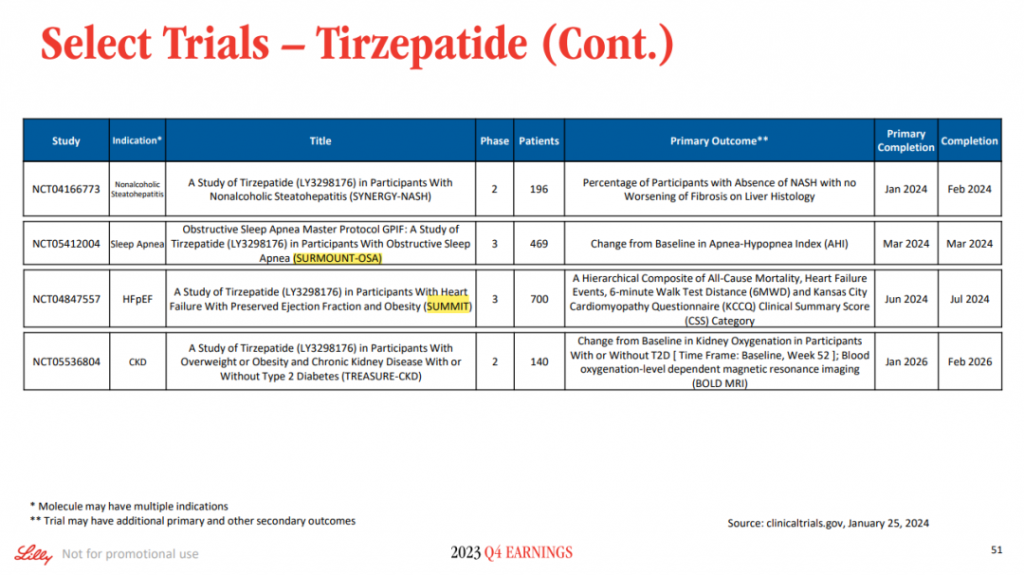
礼来即将穿越阿尔兹海默病领域的研发黑洞,享受胜利果实。Donanemab离上市已不远了,礼来预计将于今年在美日欧迎来监管点头,而且donanemab走的是常规批准途径。此前,卫材和渤健的lecanemab则是先通过FDA加速批准上市,再转成传统批准。下一代Aβ单抗remternetug也已进入III期临床阶段。Ib期研究显示,remternetug表现出深度斑块清除能力,所有剂量组都出现了剂量依赖性的淀粉样蛋白减少。礼来的另一大明星产品替尔泊肽也或将在今年创造出更多的高光时刻,III期SURMOUNT-5研究有望揭开谜底,其与司美格鲁肽在减重方面的高下之分将一目了然。根据clinicaltrials.gov网站,SURMOUNT-5研究于2023年4月启动,计划于2024年11月完成,招募人群在700例左右。一年多的时间就能够完成这一规模的III期研究,可见礼来推进临床速度之快,争分夺秒背后是与诺和诺德展开的激烈竞争。

礼来还将披露替尔泊肽用于射血分数保留的心力衰竭(HFpEF)的III期SUMMIT研究结果,另一项针对阻塞性睡眠呼吸暂停的III期SURMOUNT-OSA研究也值得期待。基于这些结果,礼来还将向FDA递交相关适应症上市申请。
替尔泊肽这一GLP-1R/GIPR双靶点激动剂已不能满足礼来在代谢领域的勃勃野心。GLP-1R/GIPR/GCGR三靶激动剂retatrutide来势汹汹。3月,礼来将启动 retatrutide头对头司美格鲁肽的III期TRANSCEND-T2D-2研究(NCT06260722),旨在评估其相较于司美格鲁肽在二甲双胍联合或不联合钠-葡萄糖共转运体2抑制剂(SGLT2i)治疗血糖控制不佳的2型糖尿病患者中的有效性和安全性。此外,礼来计划启动另一项III期研究,考察retatrutide作为慢性体重管理对心血管疾病的影响。在口服选择性雌激素受体降解剂(SERD)的开发上,礼来也备好了弹药。Imlunestrant的III期EMBER-3研究预计将于4月完成主要部分,礼来希望借此在美日欧申报上市。

诺和诺德:打开司美格鲁肽的想象空间
司美格鲁肽正在向更大的市场狂奔而去。诺和诺德预计将于今年上半年在美国和下半年在欧洲和中国迎来司美格鲁肽新适应症获批,用于降低体重指数(BMI)≥27kg/m2和已确诊心血管疾病成人的主要不良心血管事件风险。此前公布的SELECT研究结果显示,与安慰剂相比,司美格鲁肽能在长达五年的时间里将主要不良心血管事件(MACE)风险显著降低20%。基于STEP HFpEF研究的胜利,司美格鲁肽将在心血管领域再下一城,诺和诺德已在欧美地区申报HFpEF新适应症。STEP HFpEF研究纳入了529例射血分数保留的心力衰竭(HFpEF)合并BMI≥30的患者,使用KCCQ-CSS评分作为衡量HFpEF症状和身体限制的共同主要终点。在第52周时,司美格鲁肽组患者的问卷得分增加了16.6分,而安慰剂组得分增加了8.7分。因疗效优异而提前终止的III期FLOW研究将于上半年公布具体数据,届时可以感受到司美格鲁肽在慢性肾病方面的实力几何。2024H2,诺和诺德或将披露司美格鲁肽用于外周动脉疾病的III期STRIDE研究,以及口服司美格鲁肽将通过近万人的SOUL研究进一步探索其心血管获益。
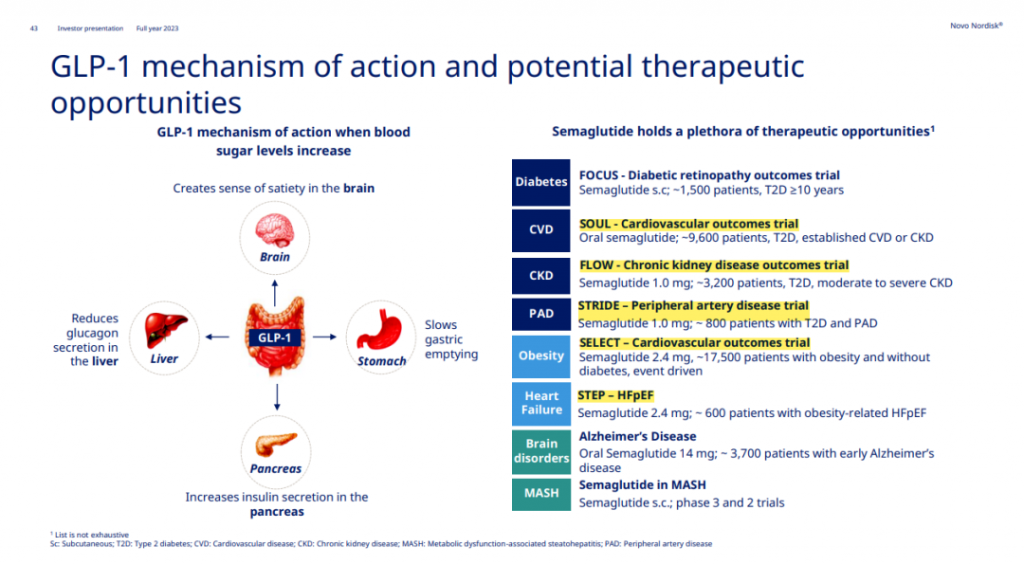
诺和诺德不仅在司美格鲁肽的新适应症挖掘上下足苦功,并开发了皮下和口服两种版本,还在单品之外,致力于开发司美格鲁肽复方制剂。由司美格鲁肽与insulin类似物组合而成的IcoSema将在上半年公布III期结果,而与amylin类似物组合而成的Cagrisema则将于下半年披露III期减重结果。至于诺和诺德能否凭借司美格鲁肽复方制剂,在代谢领域更上一层楼,我们交给时间和数据来验证。