诺华7条核药管线梳理
来源:药智头条 | 发布时间:2024-02-02
摘要:New Modality正在成为诺华业绩增长的主要驱动力。放射性配体疗法Pluvicto销售额9.8亿美元,同比增长261% ;小核酸药物Leqvio销售额3.55亿美元,同比增长217%。
1月31日,诺华公布了2023年财报。全年净销售额为454.4亿美元,同比增长10%。
诺华表示,业绩增长驱动因素包括心衰药Entresto(诺欣妥)(60.35亿美元,+31%)、多发性硬化症治疗药物Kesimpta( 21.71 亿美元,+99%)、乳腺癌治疗药物Kisqali (20.8亿美元,+75% )等。
另外New Modality正在成为诺华业绩增长的主要驱动力。放射性配体疗法Pluvicto销售额9.8亿美元,同比增长261% ;小核酸药物Leqvio销售额3.55亿美元,同比增长217%。
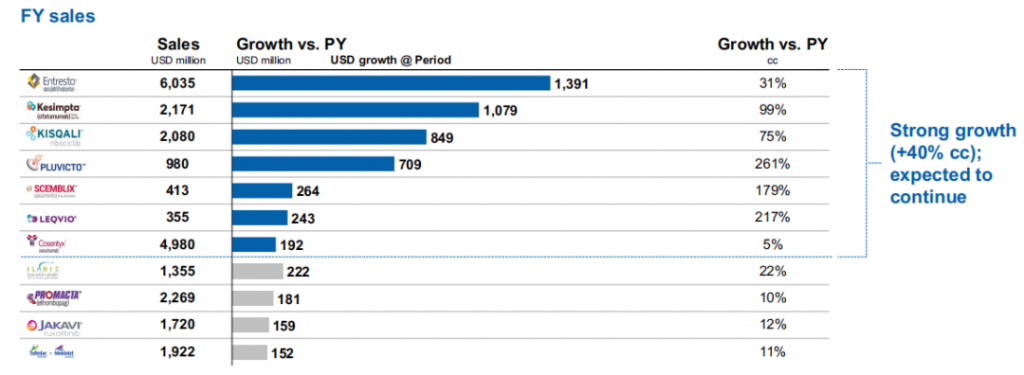
图片来源:诺华2023年报PPT
诺华在剥离山德士(Sandoz)后,已转型为一家纯粹的创新药企,目前聚焦4个核心治疗领域:心血管-肾-代谢疾病,免疫学,神经科学和肿瘤学。
在技术平台上,诺华除了传统的化药与生物药平台,还大力发展New Modality(新型疗法)平台,主要包括:RLT(核药)、CAR-T、小核酸药物。

图片来源:诺华JPM2024 PPT
RLT(核药)
过去两年,MNC们围绕ADC交易、并购热火朝天,但诺华格外淡定,在其近5年的主要BD中都未曾涉足ADC领域。根据公开信息显示,早在十多年前,诺华也曾在ADC技术方向做过尝试,不过这些ADC项目如今都已在诺华的管线里消失了。
在JPM2024会议上,诺华表示在ADC赛道耕耘已久,但并未取得积极进展。他们认为与某些 ADC 相比,放射疗法可能具有安全优势。因此希望可以发挥自身所长,加大对放射性配体疗法(radioligand therapy,RLT)的投资。
RLT具有疗效好、副作用较低等优点,是诺华在实体瘤领域最为看重的技术平台,目前已有2款产品上市,其中Pluvicto在2023年销售了9.8亿美元,距离十亿美元大关仅一步之遥。

图片来源:诺华2023年报PPT
Pluvicto
Pluvicto (177Lu-PSMA-617)是一种静脉注射的放射配体疗法,该疗法将一种靶向PSMA的小分子化合物与治疗性放射性核素镥-177结合起来。进入血液后,Pluvicto与表达PSMA的前列腺癌细胞结合,放射性核素释放的辐射能量会破坏肿瘤细胞并引发其凋亡。2018年,诺华以总价21亿美元(溢价54%)收购Endocyte,获得177Lu-PSMA-617。
2022年3月美国FDA批准Pluvicto上市,用于PSMA阳性患者的转移性去势抵抗性前列腺癌(mCRPC)三线治疗。上市当年该药销售额即达到2.71亿美元,2023年继续放量,全年销售额9.8亿美元,增长261%。
诺华还在推进Pluvicto用于更前线的治疗方案,及拓宽适用人群。在ESMO 2023年会上,诺华公布了PSMAfore试验的数据:与雄激素受体通路抑制剂(ARPI)治疗组相比,Pluvicto组达到了其主要终点,在前列腺特异性膜抗原(PSMA)阳性转移性去势抵抗性前列腺癌(mCRPC)患者中具有临床意义和统计学意义,有望推动Pluvicto向一线治疗进发。
Lutathera
诺华另一款核药Lutathera去年也取得不错成绩,销售额6.05亿美元,同比增长28%。
Lutathera (lutetium 177Lu dotatate)是一种 177Lu标记的生长抑素类似物肽,肽分子DOTA-TATE通过螯合剂与Lu-177结合,构建成新型复合药物。Lutathera注射到患者体内后,借助受体-配体的靶向识别作用,捕捉到肿瘤细胞,继而将放射性核素导入肿瘤组织,Lu-177释放高能量的β射线,最终杀灭肿瘤细胞。2017年,诺华以39亿美元收购Advanced Accelerator Applications(AAA),获得Lutathera。
Lutathera分别于2017、2018年在欧洲和美国上市,用于治疗生长抑素受体阳性的胃肠道胰腺神经内分泌肿瘤(GEP-NETs),这是首款FDA批准的放射性配体疗法。
2024年1月19日,诺华在ASCO-GI会议上公布Lutathera一线治疗胃肠胰神经内分泌瘤(GEP-NETs)3期临床NETTER-2的最新临床数据。主要终点mPFS从8.5个月延长至22.8个月,延长至近3倍,疾病进展或死亡风险降低72%,总响应率ORR高达43%。诺华预计在今年向欧盟递交一线治疗GEP-NET的上市申请,同时积极拓展SCLC、GBM新适应症,预期Lutathera销售峰值将超过10亿美元。
有了Pluvicto 和 Lutathera 的成功经验后,诺华继续加大核药领域的布局:
- 2023年3月,诺华与Bicycle Therapeut达成合作,针对多个肿瘤靶点开发、制造和商业化双环肽放射性偶联药物(BRCs)。Bicycle将获得5000万美元的预付款,并有资格获得总计17亿美元的开发和商业里程碑付款,Bicycle还将有资格获得商业化产品的分级版税。
- 2023年4月,诺华与3B Pharmaceuticals GmbH (3BP)达成合作,获得3BP公司的FAP靶向肽技术包括FAP-2286药物治疗和成像应用的全球开发和商业化独家许可权益,3BP保留了FAP靶向肽技术用于诊断目的的开发权益。3BP公司获得4000万美元的预付款,以及高达4.25亿美元的开发、商业化里程碑付款。
目前诺华有7个核药管线,包括2个上市产品和5个处于临床1期的管线。
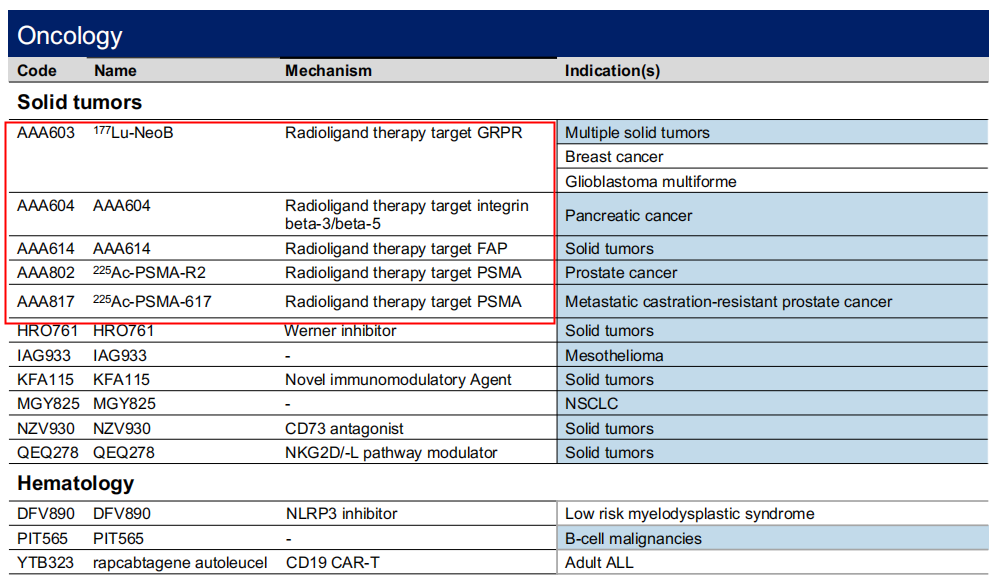
图片来源:诺华2023年报PPT
由于放射性,核药研究开发、临床试验、生产、使用都受到严格监管。而且核药需要配套生产、物流、治疗场景的特殊硬件设施,这导致了核药领域的高壁垒,其他企业想要进入参与竞争并非易事,因此未来几年诺华在核药领域都将独领风骚。
在中国,核医学起步较晚,不过也有企业已取得突破。例如,今年1月,由恒瑞医药子公司天津恒瑞牵头组建的天津市放射性药物创新联合体作为天津加快推进科技成果转化的典型案例登上央视《新闻联播》,其镥[177Lu]氧奥曲肽注射液、HRS-4357注射液和HRS-9815注射液相继获批临床。远大医药、瑞迪奥等多家企业在核药领域也相继取得突破,未来核药在抗肿瘤领域将占据更重要的地位。
CAR-T
诺华是最早进入CAR-T领域的药企之一,2017年全球首款CAR-T新药Kymriah获得FDA批准上市,开发者就是诺华。另外,诺华CAR-T产能成熟,不仅可满足自己产品的生产,也可为其他公司做CDMO服务。
2023年11月,诺华又与传奇生物强强联合,共同开发传奇生物的特定靶向 DLL3的嵌合抗原受体T细胞(CAR-T)疗法交易潜在金额11.1亿美元。
不仅仅是肿瘤领域,诺华对CAR-T在自免领域的应用也寄予了厚望,不过CAR-T存在继发癌症风险的黑框警告给其在自免领域的应用带来了很大不确定性。
小核酸
2019年11月,诺华斥资97亿美元收购The Medicines Company获得小核酸产品Leqvio,2020年,Leqvio年获FDA批准上市,2023年该药销售额3.55亿美元,诺华预计Leqvio年销售峰值将达30亿美元。

图片来源:诺华2023年报PPT
在Leqvio成功后,诺华多次加码小核酸布局:
- 2023年7月,诺华以最高10亿美元的价格宣布收购DTx Pharma。
- 2023年8月,诺华与ASO核酸药物先驱Ionis二次合作,将降血脂ASO药物Pelacarsen收入囊中。
- 2024年1月,诺华与舶望制药(Argo Biopharma)就多条小核酸管线达成合作,潜在合作总金额高达41.65亿美元。
除了心血管领域,诺华还提到目前将小核酸递送到大脑的技术取得初步成功,所以小核酸治疗神经系统疾病也是诺华看重的领域。
小 结
种种迹象表明诺华对新兴技术/新型疗法的执着,也正是这些前沿布局让诺华走出来差异化之路,尤其是在肿瘤领域,不卷PD-1、ADC,而是以核药为支撑,使其在这个竞争激烈的领域中脱颖而出。