基因编辑2.0,如何兼顾高编辑效率和低脱靶率
来源: eMedClub | 发布时间:2024-02-02
摘要:基因编辑技术经历了ZFN、TALEN、CRISPR/Cas9三代的发展历程,整体上正在从重组核酸酶介导的技术向以RNA 引导的基因编辑技术发展,相应成本在逐步降低,周期也在逐步缩短,靶向修饰的效率不断提高。CRISPR/Cas9与前两代基因编辑技术相比,靶向性更准确,切割效率更高,设计构建更容易,并且可以实现多基因编辑。
当前,随着基因编辑技术的飞速发展,每年有数千篇CRISPR相关研究论文发表,转座酶、Fanzor、表观基因组编辑的加入,让CRISPR工具箱不断扩展,但基因编辑技术在快速发展的同时,也面临着一定的瓶颈。
FDA将脱靶效应认作为潜在的安全风险

大量研究表明,基因编辑工具有时会切入错误的位点,可能会破坏非靶向基因的功能或调节,进而导致严重的后果。美国食品药品监督管理局(FDA)和国家药品监督管理局药品审评中心(CDE)将脱靶效应认作为潜在的安全风险,要求基因编辑工具必须经过严格的测试和验证,确保其在应用中的安全性和可靠性,还要求基因编辑进行临床应用时必须仔细考察基因编辑工具的脱靶效应,这也对当下的基因编辑工具提出了新的需求。
基因编辑技术革新迅速,安全性为发展基石
基因编辑技术经历了ZFN、TALEN、CRISPR/Cas9三代的发展历程,整体上正在从重组核酸酶介导的技术向以RNA 引导的基因编辑技术发展,相应成本在逐步降低,周期也在逐步缩短,靶向修饰的效率不断提高。CRISPR/Cas9与前两代基因编辑技术相比,靶向性更准确,切割效率更高,设计构建更容易,并且可以实现多基因编辑。
但脱靶效应仍然是影响基因编辑临床效果的关键因素,设计开发可以进一步提升基因编辑精度的基因编辑工具具有重要应用价值。2022年5月CDE发文《体内基因治疗产品药学研究与评价技术指导原则(试行)》,有多处涉及CRISPR-Cas产品脱靶风险控制,文中提到“对于基于 CRISPR-Cas的基因治疗产品,建议采用多种方法对编辑系统的风险进行全面的分析和评估”。例如,编辑系统自身特定的局限性、序列靶向的特异性、脱靶位点的分析、编辑酶的精准度和编辑效率、多靶点编辑的基因组重排等。
▲ 图片来源:CDE官网
FDA于2022年3月发布的《涉及基因编辑的基因治疗产品指导原则草案》也多次提到了基因编辑的脱靶风险,该法案指出,对于体外进行基因编辑的治疗产品,还需要提供脱靶编辑效率、脱靶编辑的频率、染色体重排、基因组编辑成分的残留、完成基因编辑的总细胞数。该指导草案指出了与基因组编辑相关的几个特定风险,包括脱靶编辑,靶标和脱靶编辑的意外后果,以及靶标和脱靶编辑引起的长期未知影响。

▲ 图片来源:FDA官网
对于全球首款上市基因编辑疗法Exa-cel,FDA咨询委员会在审评时着重关注CRISPR方法是否存在有害的“脱靶”效应。CRISPR /Vertex临床数据报告的44名患者中,有30名患者至少随访了16个月,没有出现不良反应。该公司表示计划在未来15年继续追踪观察患者。这表明FDA对于该CRISPR疗法的审评中对于安全标准,尤其是脱靶概率的高度关注。
为了减少脱靶编辑,科学家们已经开发出一系列具有高保真度的Cas变体,并已经初见成效,但脱靶效应无法完全消除。对于治疗相关应用来说,利用脱靶筛选和设计优化来降低脱靶效应尤其重要。赛默飞新推出的Gibco™ CTS™ HiFi Cas9 蛋白具有卓越的低脱靶特性、能够保持高靶向编辑效率,可提升敲入效率且符合GMP标准生产和法规要求,能够较好地满足客户的需求。
与CTS TrueCut Cas9 野生型蛋白相比,Gibco™ CTS™ HiFi Cas9 蛋白能够将原代免疫细胞脱靶效应降低90%以上。在实际性能测试过程中,Gibco™ CTS™ HiFi Cas9 蛋白相较于供应商A的GMP HiFi Cas9(Sup A HF)在原代人T细胞中可大幅度降低脱靶效应。经多次脱靶效应检测可以发现,供应商A的GMP HiFi Cas9(Sup A HF)仍然存在一定的脱靶情况,而Gibco™ CTS™ HiFi Cas9 蛋白的脱靶风险远远低于其他类型蛋白(图1)。
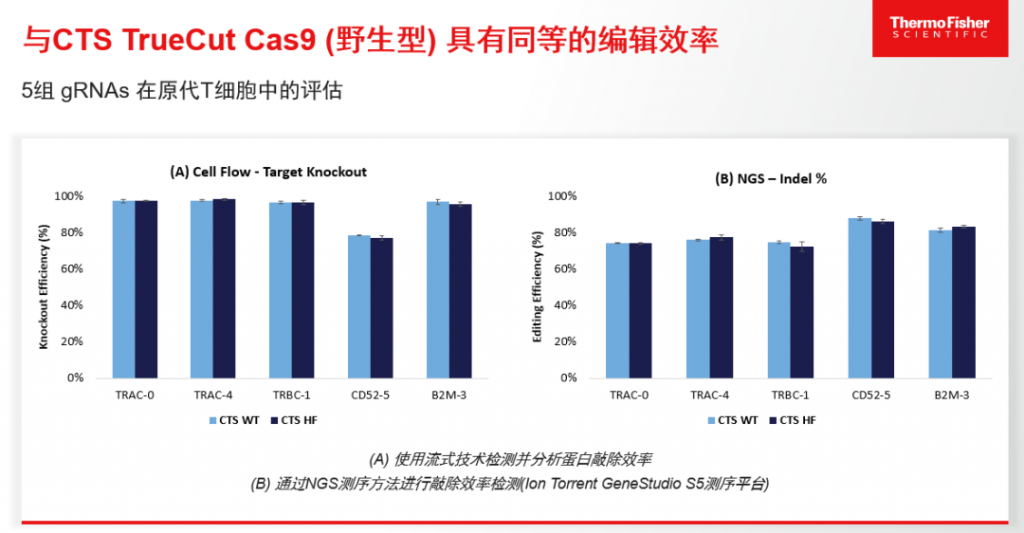
Gibco™ CTS™ HiFi Cas9 蛋白在大幅降低脱靶风险的同时,还能够保持高靶向编辑效率,且可以有效地提升基因敲入效率。通过流式技术和NGS测序方法进行敲除效率检测可以发现,Gibco™ CTS™ HiFi Cas9实现了与CTS TrueCut Cas9 野生型蛋白同等的高靶向编辑效率(图2)。
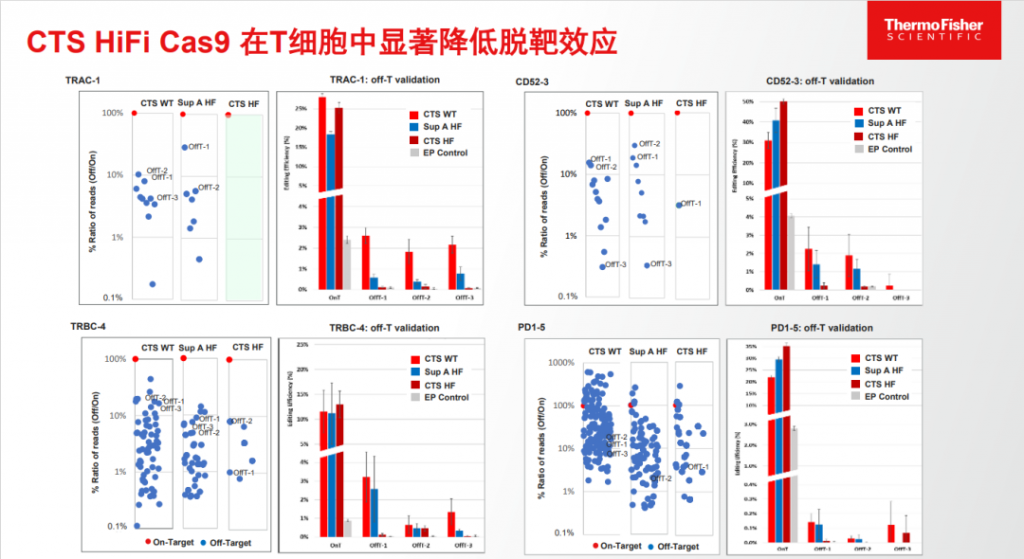
▲ 图1&图2:CTS HIFI Cas9在T细胞中显著降低脱靶效应,且维持高编辑效率。
此外, Gibco™ CTS™ HiFi Cas9 配合CTS™ Xenon™ Genome Editing Buffer (GE buffer)联用,能够在保证细胞活性的基础上,获得更高的同源重组效率。经过检测可以发现,相较于Control GE Buffer单用和CTS HiFi +R Buffer联用,CTS HiFi +GE Buffer在两个测试组中均获得了更高的同源重组效率。值得注意的是,CTS HiFi +GE Buffer在两个测试组中的同源重组效率分别高达70%和50%,是CTS HiFi +R Buffer在两个测试组中23%和18%同源重组效率的三倍(如下图)。
Gibco™ CTS™ HiFi Cas9更好支持中美临床申报的需求,该产品生产过程极为严格,符合GMP原则生产并满足细胞、基因和组织产品辅助材料标准的要求,包括USP <1043>, Ph.Eur. 5.2.12, 及ISO 20399,能够较好的满足细胞与基因治疗产品中美临床申报和商业化生产的高标准要求。
赛默飞持续创新开发多款高质量cas9蛋白,其独有的 “Gibco CTS (Cell Therapy Systems) 细胞治疗系统”整体解决方案,可为行业客户提供包含试剂、设备、一次性耗材等产品组合,已被广泛应用于细胞治疗药物商业化生产和全球200多项临床试验中。

总结
随着近几年的发展,CRISPR/Cas9技术不断得到完善,在编辑效率还是避免脱靶效应都有了明显的改善。同时,基因编辑技术从体外治疗逐渐迈向体内基因编辑治疗,CRISPR-Cas技术的广泛开发和优化已经产生了用于基因编辑的强大工具,通过将这些基因编辑工具与有效的体内递送方法相结合,科学家已经研发出多款体内基因编辑疗法,并且逐步进入了临床并展现出良好的前景。但目前仍存在一些问题限制其在实际环境中的应用,例如基因编辑工具的限制,脱靶的风险和递送的效率,如何克服这些挑战或将成为下一步研究的重点,也是开启基因编辑时代的关键钥匙。正如Jennifer所言,一切过往,皆为序章,CRISPR基因编辑的未来刚刚开始。