国家药监局药品审评中心发布《临床价值明确,无法推荐参比制剂的化学药品目录(第一批)》
来源:医药云端工作室 | 发布时间:2020-09-01
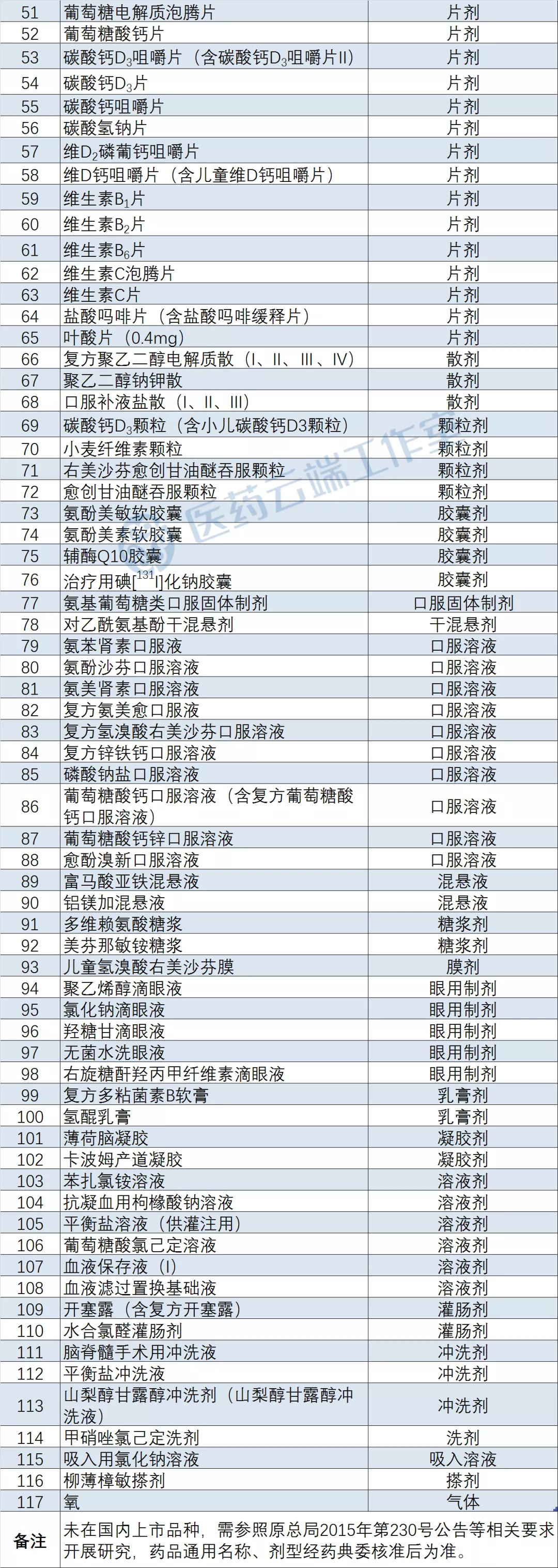
摘要:国家药监局药品审评中心发布了《临床价值明确,无法推荐参比制剂的化学药品目录(第一批)》,117个品种无需开展一致性评价。
近日,国家药监局药品审评中心发布了《临床价值明确,无法推荐参比制剂的化学药品目录(第一批)》,117个品种无需开展一致性评价,其中40个注射剂,25个片剂、3个散剂、4个颗粒剂、4个胶囊剂等,包括门冬氨酸钾镁注射液、转化糖电解质注射液、铝镁加咀嚼片等药品。
此前,在今年5月14日《国家药监局关于开展化学药品注射剂仿制药质量和疗效一致性评价工作的公告》的政策解读中,就已提到:对临床价值明确但无法确定参比制剂的化学药品注射剂仿制药,如氯化钠注射液、葡萄糖注射液、葡萄糖氯化钠注射液、注射用水等,此类品种无需开展一致性评价。虽然此次发布的117个品种不需要进行一致性评价,对于其中的独家品种来说,比如氨基酸葡萄糖注射液,本身就有着竞争优势,而那些批文动不动就上百家的品种,比如复方氯化钠注射液,全国197个批文,又如何在未来的市场准入中凸显优势?
随着药品国家集采的不断推进,药企推动一致性评价势在必行,否则将逐渐失去市场,甚至直接淘汰出局。尽管在省级或地方集采中,还在对未过评药品进行带量采购,但这些品种的竞争力已明显不足,在市场上能撑上几年还未可知。
一致性评价相关政策回顾
2007年的国家药监局在修订药品注册管理办法时,首次提出仿制药要从“仿标准”转向“仿原研”。2012年《十二五国家药品安全规划》首次提出要开展已上市后仿制药质量和疗效一致性评价。2015年12月在第43次政协双周座谈会上,围绕“仿制药的质量问题与对策”向国务院提出了建言,呼吁建立仿制药国策。
2016年3月5日,国务院办公厅印发《关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2016〕8号),标志着我国仿制药质量和疗效一致性评价工作全面启动。
2017年8月,国家药品监管部门发布《关于开展仿制药质量与疗效一致性评价有关事项的公告》,明确了一致性评价受理审批、检查检验的基本流程等。同年9月8日,药审中心对外受理一致性评价申请。
为了给一致性评价顺利推进提供条件,国家药品监管部门逐步解决生物等效性试验临床试验机构资源紧张、参比制剂难获得等难题,扎实做好参比制剂遴选,豁免体内BE品种研究,强化审评、核查、检验等各项工作。
2018年12月,国家药监局发布《关于仿制药质量和疗效一致性评价有关事项的公告》,对于基药目录品种不再设置评价时限,要求基药品种自首家通过一致性评价以后,其他品种需在3年内通过评价。
2019年3月,国家药监局发布《化学仿制药参比制剂遴选与确定程序》,明确了参比制剂遴选的顺序选择。截至2020年8月5日,国家药监局已发布32批化学仿制药参比制剂目录。
2020年5月14日,国家药监局官网发布《国家药监局关于开展化学药品注射剂仿制药质量和疗效一致性评价工作的公告》,明确已上市的化学药品注射剂仿制药,未按照与原研药品质量和疗效一致原则审批的品种均需开展一致性评价。
CDE官网也同步发布了《化学药品注射剂仿制药质量和疗效一致性评价技术要求》、《化学药品注射剂仿制药质量和疗效一致性评价技术要求》、《化学药品注射剂(特殊注射剂)仿制药质量和疗效一致性评价技术要求》三份技术文件正式稿。
而从CDE发布的第21批参比制剂目录开始,第一次出现注射剂,到目前为止,涉注射剂已超600个。这也预示着注射剂一致性评价工作正在不断加快脚步。