小核酸药物新纪元:siRNA的机制、优势与市场前景
来源:博药 | 发布时间:2025-02-15
前言
小核酸药物是继小分子类药物和抗体药物后的第三波研发浪潮,具有开发周期短、效果持久、研发成功率高、不易产生耐药性等优势。小核酸药物在基因层面进行调控,能够为目前无法治愈的严重遗传疾病提供开创性的治疗思路,已经在神经病变、心血管疾病的治疗方面展现出了巨大的潜力。其中,siRNA药物凭借丰富的研发管线和上市药物不俗的销售表现,成药性与商业化得到双重验证,已成为新药领域成功的显著代表。
siRNA的结构和作用机制
siRNA的结构
小干扰RNA(Small interfering RNA,siRNA),又称为短干扰RNA或沉默RNA,是一种双链RNA分子,长度约为21-23个核苷酸,可通过与载体共价耦联,特异性地靶向发病组织发挥基因沉默作用[1]。siRNA的双链分别称为引导链(Guided strand)和乘客链(Passenger strand),而在两端存在3′ OH二核苷酸突出端。
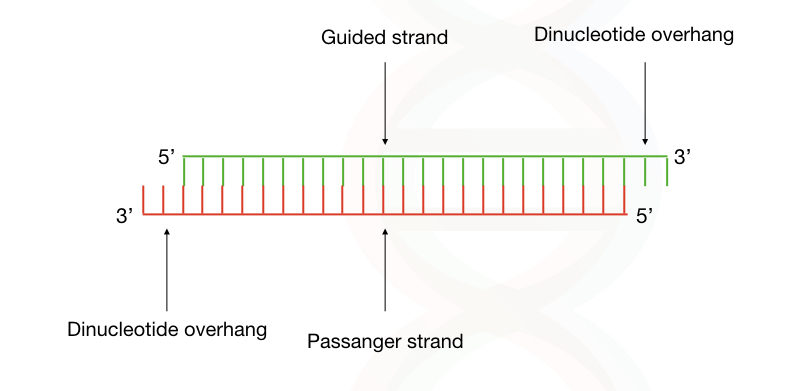
图:siRNA的结构
来源:文献资料
siRNA的作用机制
siRNA通过RNA干扰(RNAi)机制调节基因表达。RNAi是双链RNA(dsRNA)通过靶向互补mRNA进行降解来诱导基因沉默的生物学机制。siRNA介导的RNAi作用机制主要分为三个基本步骤:
1.细胞质内切核糖核酸酶Dicer将双链RNA(dsRNA)或短发夹状RNA(shRNA)切割,得到21-25bp的siRNA。
2.成熟的siRNA被组装到RNA诱导的沉默复合体(RISC)中,然后siRNA被分离成正义链和反义链,正义链从复合体中释放出来形成成熟的RISC,反义链仍然存在,作为引导复合体的向导,并将其与靶mRNA序列进行比对。
3.向导与靶mRNA互补结合触发RISC中的AGO-2内切酶切割靶序列,切割mRNA被细胞识别为异常,从而导致mRNA的降解,不能翻译成与合成蛋白质[2]。
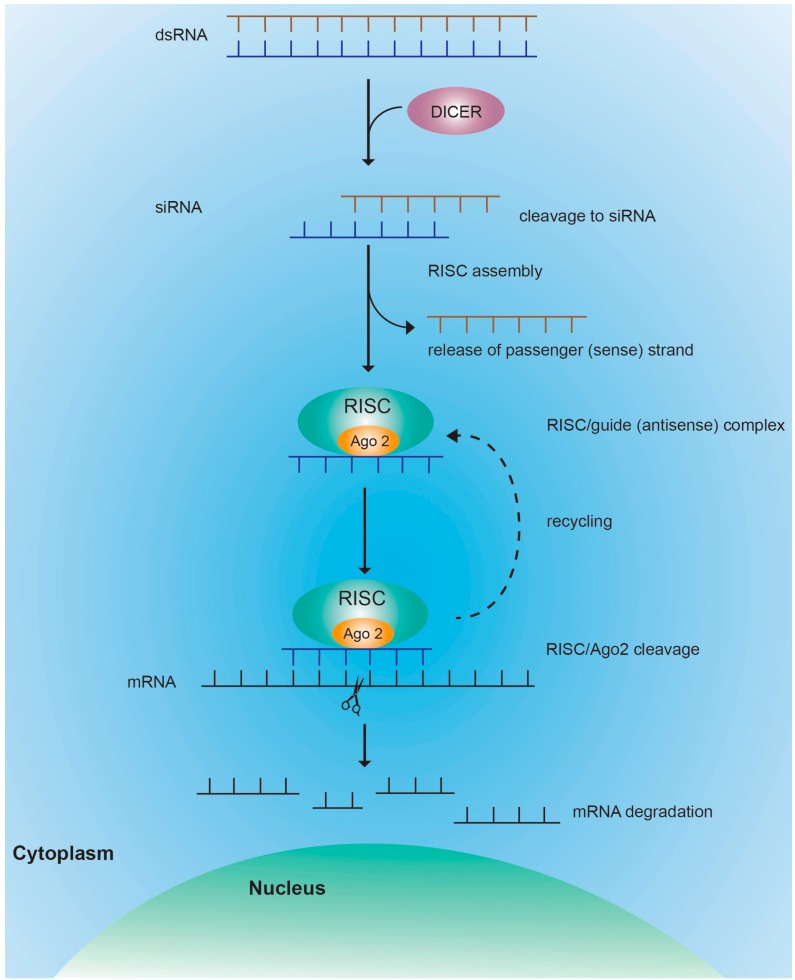
图:siRNA的作用机制
来源:文献资料
siRNA的递送系统
siRNA是一种带负电荷的大分子,细胞膜渗透性较差。因此siRNA的有效药理学使用需要能够将siRNA递送至其预期作用位点的载体,将siRNA组装成超分子复合物,在递送过程中表现出功能特性,以克服如核酸酶降解、血液循环中的免疫识别、靶组织中的积累、跨膜转运以及从内涵体和溶酶体逃逸等障碍[3]。siRNA的递送系统分为非病毒递送系统和病毒递送系统。目前已成药的siRNA药物递送系统包括脂质纳米颗粒(Lipid Nanoparticle,LNP)递送系统和N-乙酰化的半乳糖胺(GalNac)缀合递送系统,均为非病毒递送系统。最早上市的siRNA药物Onpattro采用LNP递送系统,但由于专利纠纷等因素,后续上市的siRNA药物均使用GalNac递送系统。
siRNA递送系统比较
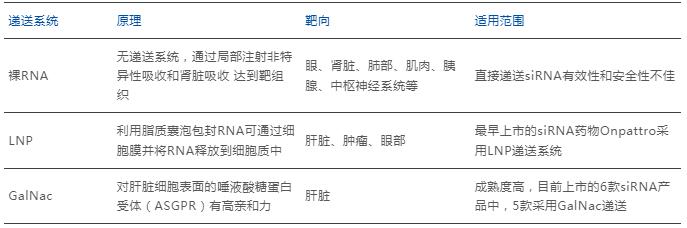
来源:公开数据,药智咨询整理
siRNA的临床优势分析
高结合特异性和安全性
siRNA与其靶标的结合具有高度选择性,由于碱基互补配对识别机制,长度为20个核苷酸的siRNA可以识别任何靶基因,具有高特异性和最小的脱靶效应,使得siRNA相比shRNA、miRNA等其他双链RNA更容易成药。同时,siRNA仅在细胞质中发挥其转录后基因沉默作用,阻止细胞核进入和基因组整合,从而最大限度地降低宿主基因突变的风险,降低siRNA药物的免疫原性和毒性。
靶点选择不受限制
小分子和单克隆抗体药物需要识别某些蛋白质的复杂空间构象,由于无法识别具有高活性、亲和力和特异性的靶分子,许多疾病无法用小分子和单克隆抗体药物治疗。相比之下,siRNA通过与mRNA与Watson-Crick碱基配对来发挥功能,从理论上讲,只需要选择沿靶向mRNA的正确核苷酸序列,任何目标基因都可以被siRNA靶向。与小分子或抗体药物相比,这一优势赋予了siRNA模式更短的研发时间和更广泛的治疗领域,有望能够靶向现有治疗方式中“无法成药”的靶点[4]。
高治疗效率
siRNA在RNA依赖性RNA聚合酶(RdRP)的作用下,会自扩增产生更多的siRNA并作用于靶mRNA。因此少量的siRNA就可以产生高效的基因沉默效果;siRNA的反义链在与靶mRNA结合后可被回收重复利用,因此一个siRNA分子可以驱动多个RISC降解靶标mRNA,从而产生持久的基因沉默效果,显著地延长给药时间。
siRNA上市及在研管线分析
siRNA上市药物分析
受限于技术的不成熟,早期的siRNA临床研究无法克服体内稳定性差、分子太大、免疫原性和不具备特定器官和组织的靶向性等成药难点。核酸化学修饰和靶向递送系统的出现为siRNA药物的研发带来转机,使得siRNA得以克服体内稳定性、毒副作用和靶向递送等障碍,在成药性上取得突破。2018年,经过高级化学修饰及结合靶向递送系统后,首个siRNA药物Patisiran获批上市。
自2018年至今,全球共计有6款siRNA药物获得了FDA的批准,适应症涵盖了淀粉样变性心肌病、淀粉样多发性神经病变、急性肝卟啉症、高草酸尿症及高胆固醇血症,主要为遗传病和肝脏相关罕见病和慢性病的治疗。Alnylam公司是全球siRNA药物领域的主要竞争者,6款上市药物中5款由Alnylam研发或参与。
全球上市siRNA药物
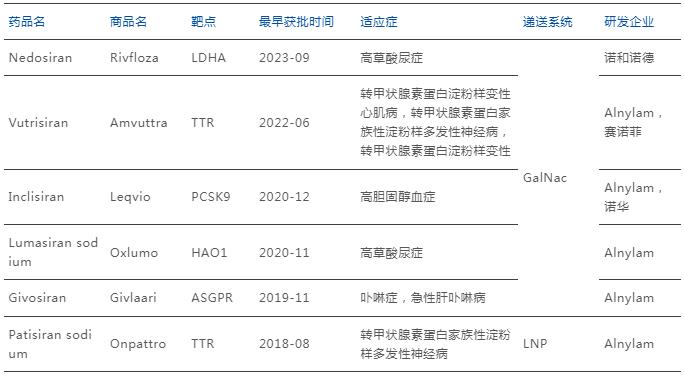
注:截至2025年1月,下同。
来源:药智数据,药智咨询整理
随着siRNA药物的不断上市,siRNA市场规模已从2018年的1300万美元增长至2023年的15.97亿美元,预计到2030年全球siRNA市场规模将达到128亿美元。其中Leqvio是全球首个适应症为慢性病的siRNA药物,其2021年获FDA批准治疗高水平低密度脂蛋白胆固醇(LDL-C)的成人患者,上市后持续放量,2023年销售额达到3.55亿元,2024年前三季度总销售额达到5.31亿美元。Leqvio于2023年8月获国家药监局批准上市(商品名:乐可唯),是国内目前唯一上市的siRNA药物,作为饮食的辅助疗法,用于成人原发性高胆固醇血症(杂合子型家族性和非家族性)或混合型血脂异常患者的治疗。
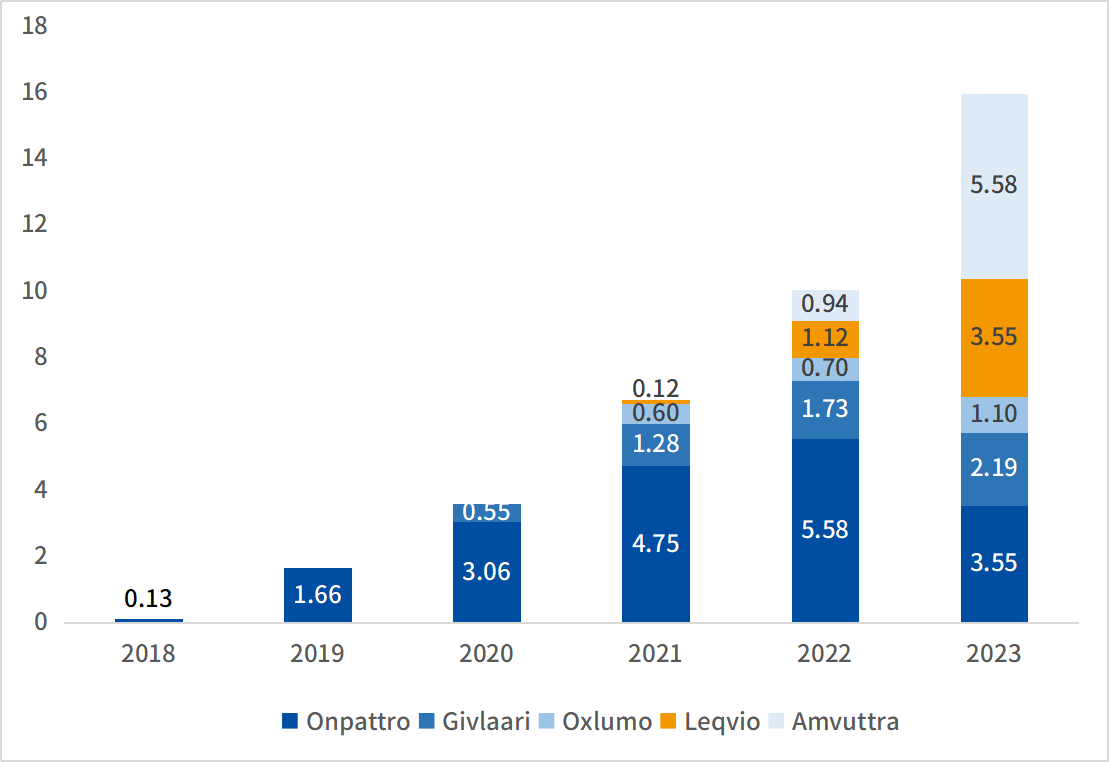
图:全球2018-2023年siRNA药物市场规模(亿美元)
来源:企业年报,药智咨询整理
siRNA在研管线分析
siRNA药物高特异性、成药靶点广等临床优势,以及上市药品优异的疗效及销售表现,全球企业对siRNA药物领域的布局热情再度燃起。目前全球进入临床试验阶段的siRNA药物管线约有140余条,整体来看,全球siRNA新药处于早期研发阶段,处于临床I期和II期的管线占全部在研管线的52%和37%。
目前发展较为成熟的siRNA递送系统如GalNac为肝脏递送,因此许多siRNA在研管线布局可通过调控蛋白表达治疗的肝脏相关疾病,目前进入临床后期的siRNA管线的适应症多为肝脏相关罕见病、代谢性疾病、遗传性疾病和眼病等。临床早期的siRNA管线中,siRNA的高治疗效率使其在慢病治疗领域具备依从性优势,在Leqvio优秀的疗效和市场成绩的推动下,研发企业在肝脏相关慢性病如高血脂、乙肝等适应症广泛布局;而在肝外靶向方面,全球药企在新递送系统上不断探索,在研管线的适应症拓展到肿瘤、心血管、神经系统、免疫系统等疾病领域,目前已在中枢神经系统和肝脏递送上取得一定突破,如Alnylam基于C16中枢神经系统递送平台的ALN-APP已进入I期临床,适应症为阿尔茨海默病。
全球在研siRNA药物(临床后期)
注:截至2025年1月,下同。
来源:药智数据,药智咨询整理
目前我国进入临床试验阶段的siRNA药物管线共30余条,其中已有6条管线进入临床III期研究,研发单位多为海外药企,适应症多为高胆固醇血症等心血管疾病。处于临床前期的管线适应症扩展至多种慢性疾病,包括高血脂、乙肝病毒感染和高血压,其中适应症为乙肝病毒感染的国内管线有4条已进入临床II期。
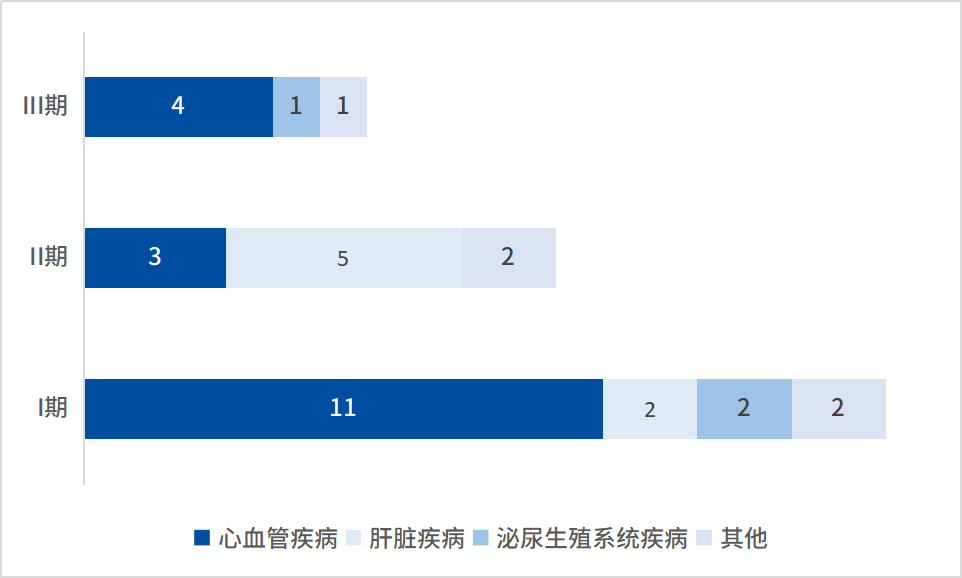
图:国内siRNA药物临床研究进度和适应症布局
来源:企业年报,药智咨询整理
小结
小核酸药物凭借多方面的临床优势和在不可成药靶点的治疗潜力成为全球药物研发的新热点。其中,siRNA药物凭借丰富的研发管线以及不俗的销售表现,成为新药领域成功的显著代表。siRNA通过RNA干扰(RNAi)机制调节基因表达,在靶标结合选择性、安全性、有效性和靶点选择方面具备多方面的优势。目前全球已有6款siRNA药物获FDA的批准上市,总销售额在2023年达到15.97亿美元,超过140条管线处于临床研究阶段;国内已有1款siRNA药物获批上市,共有30余条管线进入临床研究。随着技术的不断改进,siRNA的适应症逐渐从遗传病和罕见病覆盖至乙肝、高血压等常见慢性病,展现出巨大的临床潜力。预计未来随着在更多适应症的实用性扩展,siRNA药物将为患者带来更多治疗选择。