10月全球最新获批药品数环比锐减
来源:火石创造 | 发布时间:2022-11-03
摘要:2022年10月,全球批准新药数量锐减。FDA批准5款新药(NDA/BLA),包含0款新获批的新分子实体药物(NDA:Type 1 - New Molecular Entity),2款生物制品药物(BLA),其中TECVAYLI是一款首创的(first-in-class)BCMAxCD3双特异性T细胞结合抗体;EMA新授权0款药品上市;NMPA批准0款创新药上市。医疗器械方面,FDA没有通过上市前批准(PMA)途径首次上市的产品。境内公示了6个三类医疗器械进入创新审批绿色通道,批准了3个创新器械上市,境内医疗器械审批集中在体外诊断试剂,共439项,占37.05%。
2022年10月,全球批准新药数量锐减。FDA批准5款新药(NDA/BLA),包含0款新获批的新分子实体药物(NDA:Type 1 – New Molecular Entity),2款生物制品药物(BLA),其中TECVAYLI是一款首创的(first-in-class)BCMAxCD3双特异性T细胞结合抗体;EMA新授权0款药品上市;NMPA批准0款创新药上市。
医疗器械方面,FDA没有通过上市前批准(PMA)途径首次上市的产品。境内公示了6个三类医疗器械进入创新审批绿色通道,批准了3个创新器械上市,境内医疗器械审批集中在体外诊断试剂,共439项,占37.05%。
一、全球药品获批情况
(一)美国FDA批准情况
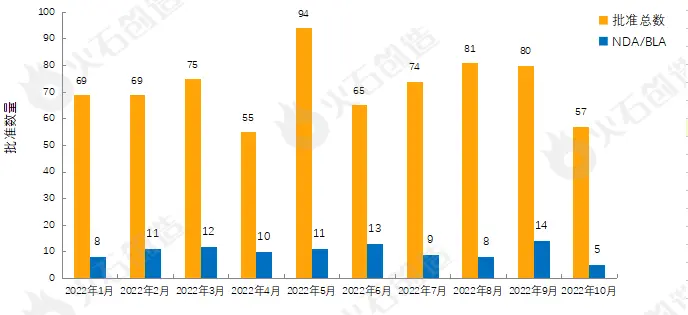
图1:2022年1—10月FDA药物批准数量变化情况
如图1,截至2022年11月2日FDA官网披露,2022年10月FDA共完成57项药品首次批准(不包含暂时批准),其中NDA/BLA批准5款(不包含暂时批准),见表1。其中包括0款新获批的新分子实体药物(NDA:Type 1 – New Molecular Entity),2款生物制品药物(BLA)。
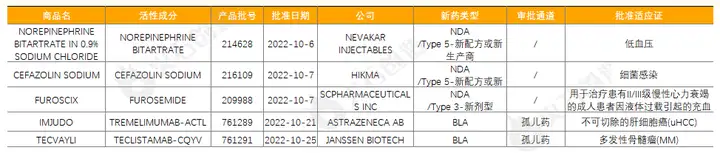
阿斯利康的抗CTLA-4疗法IMJUDO,本次获批联合抗PD-L1疗法IMFINZI(度伐利尤单抗),用于治疗不可切除性肝细胞癌(HCC)成人患者,该组合具有一种新的给药和治疗方案,名为STRIDE方案;强生旗下杨森制药的TECVAYLI是第一个被批准用于治疗多发性骨髓瘤(MM)的双特异性抗体疗法,也是一款首创的(first-in-class)BCMAxCD3双特异性T细胞结合抗体,用于治疗先前接受过4线或多线治疗的复发或难治性(R/R)多发性骨髓瘤(MM)成人患者。
表1:2022年10月FDA批准NDA/BLA药物列表
(二)欧盟EMA批准情况
产业大脑截至2022年11月2日EMA官网披露,2022年1月至10月的推荐上市药品及新活性物质(NAS)数量情况见图2,2022年10月EMA未推荐药品上市。
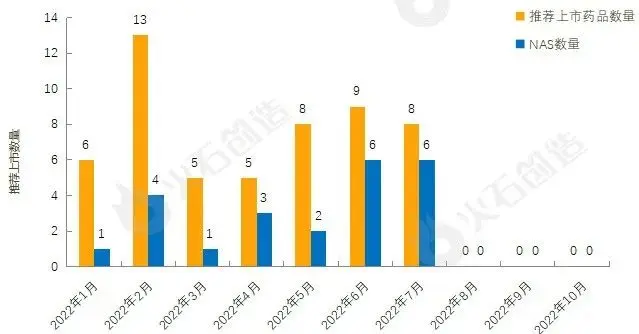
图2:2022年1—10月EMA推荐上市药品数量变化情况
截至2022年11月2日,EMA在10月新授权0款药品上市。
(三)NMPA批准情况
截至2022年11月2日NMPA披露,2022年10月共批准国产首次注册药品42件。按剂型去重后,共33个药品品种(不同厂家生产同一药物按同一品种计算)。本月1类创新药获批0个。
(四)仿制药一致性评价情况
截至2022年11月2日CDE官网披露,CDE共承办药品一致性评价受理号4299个,2022年10月共新增承办62个受理号。截至2022年11月2日,共4872个品规上市药品通过一致性评价(包含视同通过2050个品规),本月共63个品规的药品通过一致性评价(包含视同通过7个品规),按剂型去重后,共42个药品品种。
目前一致性评价品种通过的注射剂共 1775个品规(263个品种),本月过评药品中共计34个品规(19个品种)的注射剂。2022年1月至10月通过一致性评价数量见图3。
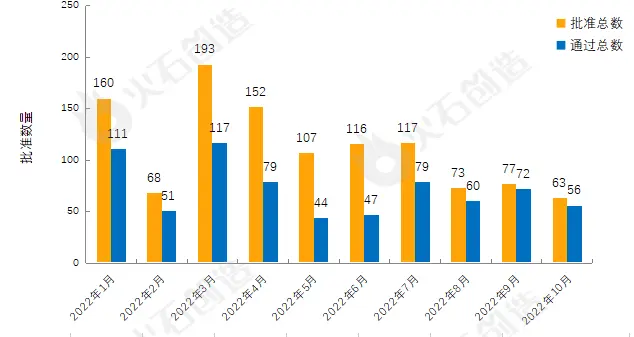
图3:2022年1—10月仿制药一致性评价批准数量变化情况
二、全球医疗器械获批情况
(一)美国FDA批准情况
截至2022年11月2日,10月FDA共批准290个510(k)途径的产品,其中一类器械25个,二类器械258个,未分类7个。
通过对510(k)上市前通知的器械根据美国医学专业用途进行分类,结果发现,10月产品获批类型最多的为骨科器械、一般和整形手术器械、一般医院和个人使用类器械、心血管器械与放射科器械,见图4。
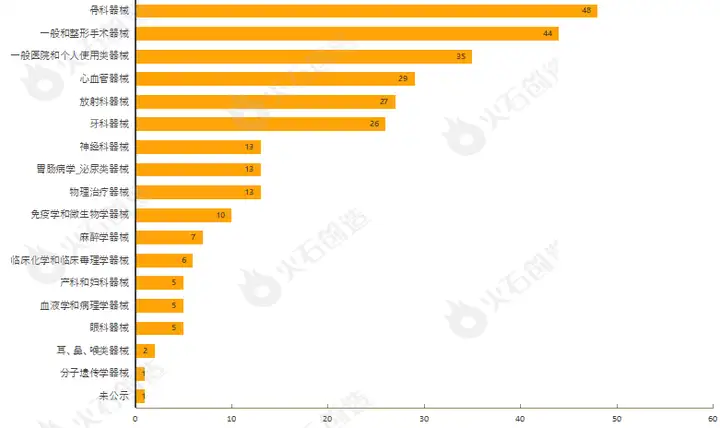
图4:2022年10月通过FDA 510(k)途径获批上市产品类型分布情况
2022年10月没有通过上市前批准(PMA)途径首次上市的产品。
(二)境内批准情况
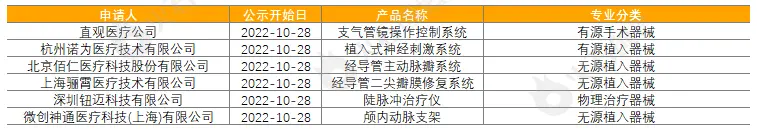
截至2022年11月2日,2022年10月国家局公示了6个三类医疗器械进入创新审批绿色通道,见表2。
表2:2022年10月进入绿色通道的三类创新器械
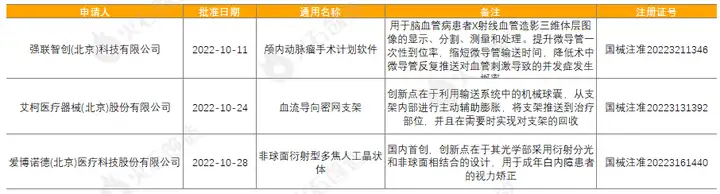
截至2022年11月2日,2022年10月国家局公示了3个三类创新器械获批上市,见表3。
表3:2022年10月获批上市的三类创新器械
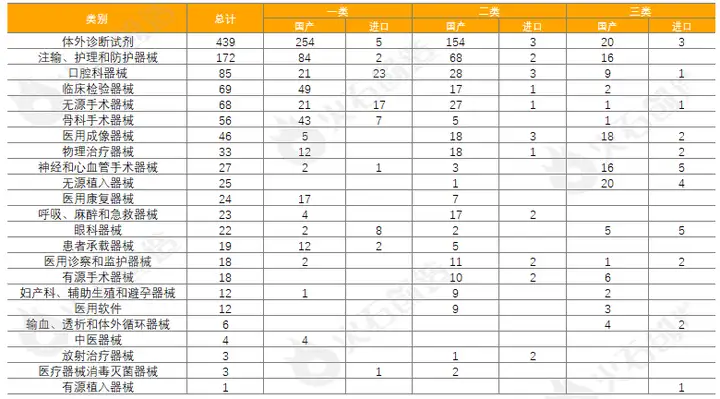
截至2022年11月2日,2022年10月国家局共批准首次注册三类医疗器械产品152个,其中国产124个,进口28个。各省级药品监管部门10月共批准国产第二类医疗器械注册412个,一类备案医疗器械533个。
产业链监测统计数据显示,体外诊断试剂数量最多,共439项,占37.05%,基本上均为国产,为428项。除体外诊断试剂,批准注册类别数量排前三位的分别为注输、护理和防护器械,口腔科器械和临床检验器械。
表4:2022年10月国产、进口医疗器械批准注册类别数目分布情况
从地域分布上,2022年10月国产二、三类注册产品批件最多的依次为广东省(142件)、江苏省(110件)、湖北省(68件)三个区域,见图5。
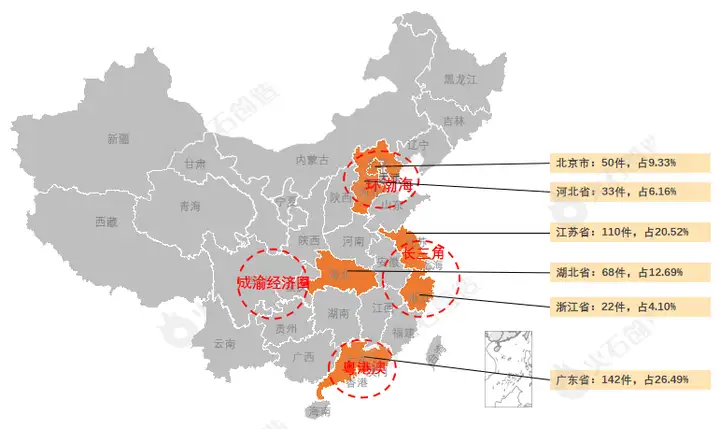
图5:国产获批器械区域分布