癌症疫苗如何改变肿瘤治疗格局
来源:生物制品圈 | 发布时间:2025-05-14
摘要:癌症疫苗作为免疫治疗的重要手段,分为预防性和治疗性两类,在对抗癌症方面发挥着关键作用。预防性疫苗可降低病毒相关癌症的发生风险,治疗性疫苗则旨在激活免疫系统来对抗肿瘤。近年来,疫苗平台取得了显著进展,然而,癌症疫苗在临床应用中仍面临诸多挑战,如抗原选择、肿瘤免疫抑制等问题。本文将全面分析癌症疫苗的分类、新抗原的发现、疫苗递送平台的进展、佐剂的作用、联合治疗策略以及临床面临的挑战,并对未来研究方向进行展望,旨在为癌症疫苗的发展提供全面的认识和参考 。
摘要:癌症疫苗作为免疫治疗的重要手段,分为预防性和治疗性两类,在对抗癌症方面发挥着关键作用。预防性疫苗可降低病毒相关癌症的发生风险,治疗性疫苗则旨在激活免疫系统来对抗肿瘤。近年来,疫苗平台取得了显著进展,然而,癌症疫苗在临床应用中仍面临诸多挑战,如抗原选择、肿瘤免疫抑制等问题。本文将全面分析癌症疫苗的分类、新抗原的发现、疫苗递送平台的进展、佐剂的作用、联合治疗策略以及临床面临的挑战,并对未来研究方向进行展望,旨在为癌症疫苗的发展提供全面的认识和参考 。
一、癌症疫苗的分类及作用
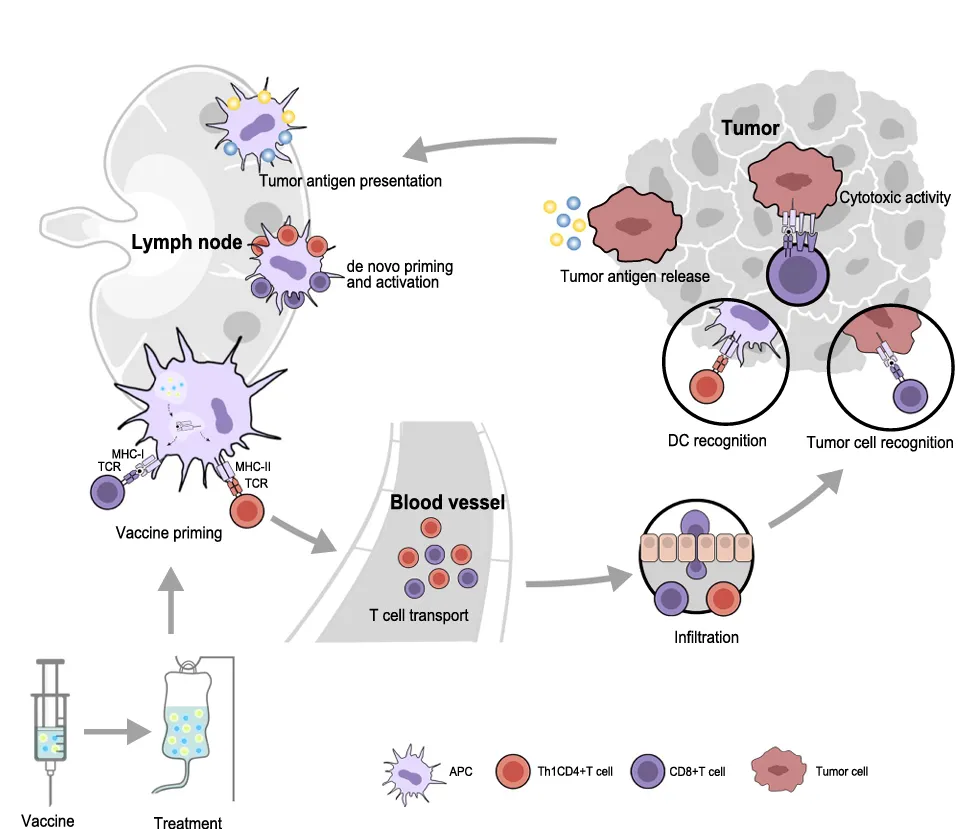
癌症疫苗是免疫治疗的重要组成部分,主要分为预防性和治疗性两种 。预防性癌症疫苗如 HPV 疫苗和乙肝疫苗,能够预防病毒感染引发的癌症,在健康人群中接种,可以有效降低癌症的发病几率 。治疗性癌症疫苗则是通过激活树突状细胞(DCs)和细胞毒性 T 淋巴细胞(CTLs),增强人体对肿瘤的免疫反应,从而识别并清除癌细胞,同时还能形成长期免疫记忆,预防肿瘤复发(参考图1 Immune response induced by therapeutic cancer vaccines,可更直观地了解治疗性癌症疫苗诱导免疫反应的过程 )。
二、合适的肿瘤抗原
肿瘤疫苗主要由肿瘤抗原、递送平台和免疫佐剂组成,其中肿瘤抗原的精准检测对疫苗有效性至关重要 。肿瘤抗原分为共享抗原和个性化抗原 。共享抗原包含肿瘤相关抗原(TAAs)和肿瘤特异性抗原(TSAs),像癌胚抗原(CEA)、前列腺特异性抗原(PSA)等属于 TAAs,但它存在一些局限性,比如会引发机体的免疫耐受,还可能导致自身免疫毒性 。TSAs 是癌细胞特有的抗原,能引发更具针对性的免疫反应,但数量较少 。如今,新抗原成为研究热点,通过质谱(MS)、全外显子测序(WES)等技术可以精准识别新抗原,为个性化癌症疫苗的开发提供依据 。例如,Tedopi、Neo – MoDC、TG4050 等疫苗都基于新抗原开发,在临床试验中展现出一定的潜力 。
三、癌症疫苗平台
1.合成肽癌症疫苗:这类疫苗分为 HLA 限制的短肽和非 HLA 限制的长肽 。短肽疫苗生产成本低、可修饰性强,但存在免疫原性不足等问题,它难以激活 CD4 + 辅助性 T 细胞,还可能导致 T 细胞功能障碍 。不过,像 gp100、WT1 等短肽疫苗在临床试验中也取得了一些积极成果 。长肽疫苗能同时激活多个 T 细胞,免疫反应更强且毒性较低,如针对 HPV16 E6 和 E7 序列的长肽疫苗在临床评估中表现出低毒性 。此外,还有多价、肽鸡尾酒和混合形式的创新肽疫苗,也在推动免疫反应方面发挥着积极作用 (相关疫苗信息可查看表1 Cancer vaccines with available clinical data)。
2.核酸癌症疫苗:包括 DNA 和 mRNA 癌症疫苗 。DNA 癌症疫苗稳定性好,能引发持久免疫反应,但免疫原性较低,且使用病毒载体可能存在安全隐患 ,如 INO – 5401 就是一种 DNA 癌症疫苗。mRNA 癌症疫苗在细胞质中合成蛋白质,避免了一些安全问题,并且具有高效表达抗原的优势,但它在细胞质中存在时间短,需要有效的递送方法 。目前,mRNA – 4157、JCXH – 211 等 mRNA 癌症疫苗在临床试验中展现出良好的效果 。
3.细胞癌症疫苗:分为自体和异体两类 。自体细胞疫苗如 GVAX,由基因改造的肿瘤细胞分泌 GM – CSF 来增强免疫反应,但在临床实践中的效果有限 。异体肿瘤细胞疫苗以已建立的恶性细胞系为来源,成本效益高,如 HS – 110 在与 nivolumab 联合使用时,对先前免疫治疗耐药的患者有一定疗效 。DC 癌症疫苗具有强大的抗原呈递能力和免疫原性,像 sipuleucel – T、DCVax – L 等在治疗前列腺癌、胶质瘤等方面取得了不错的成果 。
4.病毒癌症疫苗:利用病毒的免疫原性,通过基因工程改造使其携带肿瘤抗原,能有效将抗原传递给免疫细胞,增强抗肿瘤免疫反应 。例如,Talimogene laherparepvec(T – VEC)可表达 GM – CSF,在治疗黑色素瘤时显著提高了持久缓解率;VRP – HER2 疫苗在乳腺癌的临床前和临床试验中均展现出良好效果;VBI – 1901 针对巨细胞病毒(CMV)抗原,已获得 FDA 的快速通道指定和孤儿药地位,用于治疗复发性胶质母细胞瘤 。
5.癌症纳米疫苗:借助智能纳米载体共递送抗原和佐剂,能够实现有效靶向递送,增强抗原摄取和呈递,激活特异性免疫反应以消除肿瘤细胞 。如 Wu 等人研发的纳米颗粒癌症疫苗可抑制肿瘤生长,dClip – LNP/siRNA 纳米疫苗能增强抗原呈递,CS – TEMPO – OVA 疫苗与 aPD – 1 联合使用时可有效抑制肿瘤转移 。然而,癌症纳米疫苗在临床应用中效果参差不齐,存在抗原负载 DCs 功能不足、制造工艺复杂和成本高等问题 。
四、佐剂在癌症疫苗中的作用机制
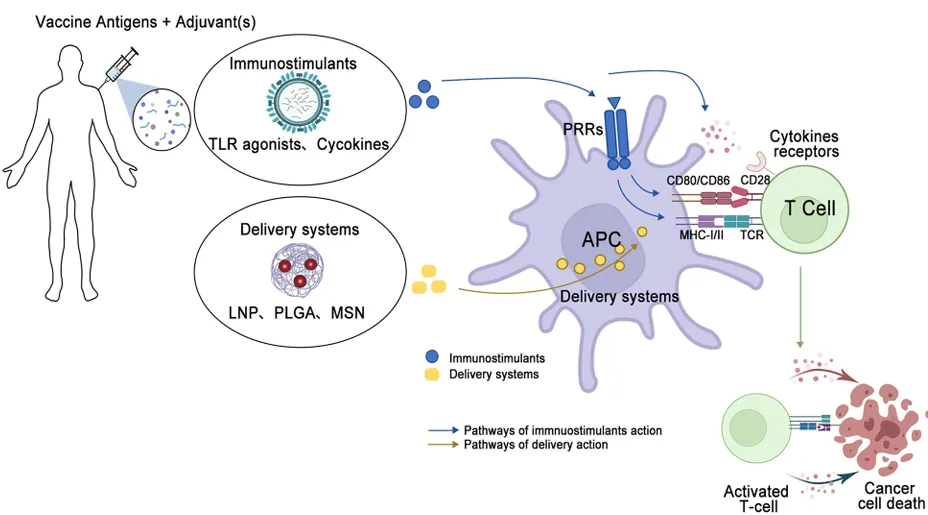
佐剂在癌症疫苗中至关重要,它能增强疫苗平台的免疫原性,刺激免疫系统 。主要分为递送系统和免疫刺激剂两类(结合图2 General schematic of the mechanism of action of adjuvanted cancer vaccines,可以更清楚地了解其分类和作用机制 )。免疫刺激剂如 Toll 样受体(TLR)激动剂,可激活抗原呈递细胞(APCs)上的模式识别受体(PRRs),促进抗原呈递和共刺激信号的产生,像 Poly – I:C 和 Poly – ICLC 可刺激 IFN -β 和促炎细胞因子的产生 。细胞因子如 IL – 12 和 IL – 2 能增强肿瘤特异性 T 细胞的增殖和激活 ,但使用时需注意其可能带来的不良反应 。脂质体、脂质纳米颗粒(LNPs)等递送系统可帮助抗原呈递在 MHC 分子上,促进 APC 与 T 细胞的相互作用,增强免疫反应 。此外,颗粒佐剂如介孔二氧化硅纳米颗粒(MSNs)、病毒样颗粒(VLPs)和油包水乳液等,也能增强抗原递送和免疫激活 (各类佐剂的详细信息可查看表2 Summarize of cancer vaccine adjuvants) 。
五、癌症疫苗与其他治疗方法的联合应用
由于肿瘤抗原的局限性和肿瘤的异质性,癌症疫苗单药治疗的临床效果有限,联合治疗成为未来癌症治疗的重要方向(参考表3 Summary of some vaccine combination therapies in phase II/III clinical trials with positive results和图 3 Diagram of the mechanism of different combinations of therapies after a patient has been vaccinated against cancer,了解联合治疗的具体方案和机制 )。

1.与化疗联合:化疗可以破坏肿瘤及其周围组织,释放更多抗原,促进 T 细胞招募到肿瘤微环境中,与癌症疫苗联合使用能增强疗效,降低免疫逃逸风险 。例如,HPV 疫苗 CervISA 与化疗联合用于晚期宫颈癌患者,可消除抑制性髓细胞,引发强烈的 T 细胞反应;DC 疫苗 DCVAC/LuCa 与化疗联合治疗驱动基因阴性的晚期非小细胞肺癌,患者的生存期得到延长 。
2.与放疗联合:放疗可通过多种机制增强癌症疫苗诱导的免疫反应,如扩大 T 细胞数量、吸引 T 细胞到辐射部位等 。临床研究表明,avipox 病毒疫苗与放疗联合使用,可使前列腺癌患者的 PSA 特异性 T 细胞增加;在三阴性乳腺癌中,放疗能促进肿瘤细胞表达 MHC – I/II 分子,增强新抗原呈递 。不过,放疗也可能产生免疫抑制作用,因此需要密切监测患者的免疫状态 。
3.与免疫检查点抑制剂(ICIs)联合:新抗原疫苗可产生抗原特异性 T 细胞,但这些 T 细胞常表达免疫抑制标记 。阻断 PD-1/PD-L1 信号通路可逆转免疫抑制微环境,与癌症疫苗联合可能产生协同抗肿瘤效应 。例如,mRNA-4157 疫苗与 pembrolizumab 联合用于治疗 HPV 阴性的头颈部鳞状细胞癌和黑色素瘤,显著提高了患者的缓解率和无进展生存期 。但这种联合治疗也面临成本高、副作用和疗效不一致等问题 。
4.与 CAR-T 疗法联合:CAR-T 疗法是一种创新的精准靶向免疫疗法,但高剂量输注可能导致细胞因子释放综合征(CRS),限制了其临床应用 。与癌症疫苗联合使用,或许能够减少 CAR – T 细胞的输注量,并诱导针对特定肿瘤抗原的长期免疫记忆 。研究显示,针对 CAR – T 细胞识别抗原的疫苗,不仅能激活 CAR – T 细胞,还能刺激其他 T 细胞群体识别更多肿瘤抗原,从而提升整体疗效 。例如,一项针对实体瘤的试验(NCT04503278)评估了 RNA 疫苗联合靶向肿瘤新抗原 claudin 6 的 CAR – T 细胞的疗效,初步结果显示出一定的治疗潜力,但该联合治疗仍面临成本高、制造工艺复杂和潜在安全风险等挑战 。
六、临床挑战
1.癌症疫苗制备:开发癌症疫苗首先要确定能引发免疫反应的抗原,针对肿瘤新抗原的疫苗有望激发更强免疫反应且降低自身免疫毒性,这需要借助基因工程技术和病毒载体等进行抗原生产和靶向递送 。同时,肿瘤微环境中的免疫抑制细胞和因子会阻碍抗肿瘤反应,因此消除这些抑制因素是开发癌症疫苗的关键策略之一 。
2.动物模型选择:在癌症疫苗的临床前研究中,合适的动物模型对评估疫苗的安全性和有效性至关重要 。常用的小鼠模型如人外周血单个核细胞(Hu – PBMC)模型和人造血干细胞(Hu – HSC)模型各有优缺点 。Hu – PBMC 模型可快速重建成熟活化的人 T 淋巴细胞,但存在致死性移植物抗宿主病(GvHD)风险;Hu – HSC 模型能重建多种人造血细胞,但 T 细胞发育和抗体类别转换存在缺陷 。此外,器官芯片技术等新兴替代技术逐渐兴起,已在部分情况下取代传统动物研究,但在早期临床试验中仍需关注参与者的安全性 。
3.不良事件管理:癌症疫苗相关的不良事件(AEs)较为复杂,受多种因素影响,包括靶向抗原、剂型、佐剂以及免疫刺激剂可能引发的自身免疫反应等 。一般来说,癌症疫苗的不良事件多为轻度,如注射部位反应、流感样症状等,通常在 24 – 48 小时内缓解 。不过,也有一些严重不良事件的报道,如 sipuleucel – T 疫苗可能导致脑血管事件的发生率增加 。目前,针对创新型 mRNA 癌症疫苗的研究致力于在提高疗效的同时,降低不良事件的发生 。
七、结论
随着免疫肿瘤学的发展,免疫检查点抑制剂和过继细胞疗法已证明免疫治疗在肿瘤治疗中的可行性 。癌症疫苗在抗原选择、疫苗平台和联合治疗等方面取得了显著进展,mRNA 疫苗在临床试验中的表现令人期待 。未来的研究应着重于筛选个性化抗原,开发更优的疫苗载体和佐剂,以及克服肿瘤微环境的免疫抑制 。通过不断优化疫苗设计、改进递送系统和完善联合治疗策略,癌症疫苗有望为癌症患者带来更好的治疗效果,推动个性化癌症免疫治疗的发展 。