盘点 | 9月全球最新获批药品和器械清单
来源:火石创造 | 发布时间:2022-10-13
摘要:2022年9月,全球批准新药数量大幅增长。FDA批准14款新药(NDA/BLA),包含5款新获批的新分子实体药物(NDA:Type 1 - New Molecular Entity),5款生物制品药物(BLA);EMA新授权5款药品上市,其中4款新活性物质(NAS);NMPA批准2款创新药上市,属中药,为人福医药的广金钱草总黄酮提取物及胶囊。 医疗器械方面,FDA有1个通过上市前批准(PMA)途径首次上市的产品。境内公示了9个三类医疗器械进入创新审批绿色通道,批准了2个创新器械上市,境内医疗器械审批集中在体外诊断试剂,共909项,占32.78%。
2022年9月,全球批准新药数量大幅增长。FDA批准14款新药(NDA/BLA),包含5款新获批的新分子实体药物(NDA:Type 1 - New Molecular Entity),5款生物制品药物(BLA);EMA新授权5款药品上市,其中4款新活性物质(NAS);NMPA批准2款创新药上市,属中药,为人福医药的广金钱草总黄酮提取物及胶囊。
医疗器械方面,FDA有1个通过上市前批准(PMA)途径首次上市的产品。境内公示了9个三类医疗器械进入创新审批绿色通道,批准了2个创新器械上市,境内医疗器械审批集中在体外诊断试剂,共909项,占32.78%。
全球药品获批情况
(一)美国FDA批准情况
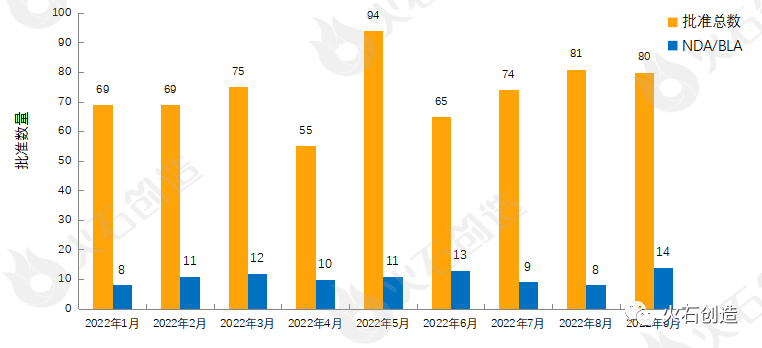
图1:2022年1—9月FDA药物批准数量变化情况
来源:美国食品药品监督管理局
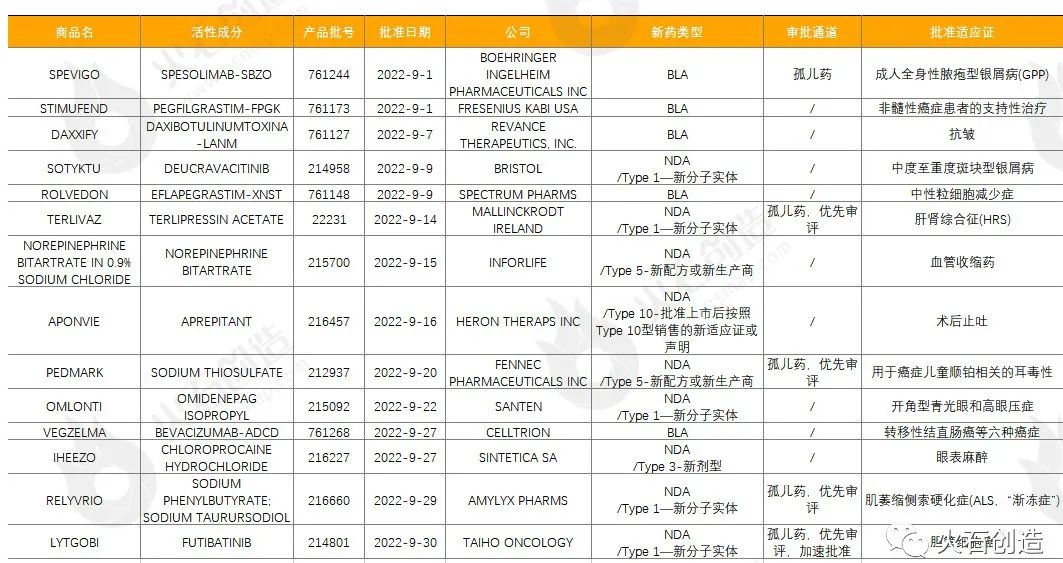
如图1,截至2022年10月11日FDA官网披露,2022年9月FDA共完成80项药品首次批准(不包含暂时批准),其中NDA/BLA批准14款(不包含暂时批准),见表1。其中包括5款新获批的新分子实体药物(NDA:Type 1 - New Molecular Entity),5款生物制品药物(BLA)。
勃林格殷格翰公司的SPEVIGO是全球首个白细胞介素 36 受体(IL-36R)单抗,获FDA批准用于成人泛发性脓疱型银屑病发作;SOTYKTU是一种首创的口服选择性变构酪氨酸激酶2(TYK2)抑制剂,是全球唯一获批的TYK2抑制剂,也是近10年来中重度斑块型银屑病口服治疗的首个创新药物;TERLIVAZ是美国首个治疗成人肝肾综合征肾功能快速下降的药物,是一款有选择性的加压素类似物;PEDMARK(硫代硫酸钠注射液)是FDA首个批准用于降低癌症儿童顺铂相关的耳毒性的治疗方法,可帮助患者降低听力损失的风险;RELYVRIO是首款在随机、安慰剂对照临床试验中显著延缓渐冻症疾病进展并能延长生存期的治疗药物,也是百年来FDA批准的第3款渐冻症治疗药物;LYTGOBI是在美获批的胆管细胞癌第三款FGFR靶向药,此前曾获得FDA的突破性疗法、孤儿药和优先审评资格,此次通过加速批准获批上市。
表1:2022年9月FDA批准NDA/BLA药物列表
来源:美国食品药品监督管理局
(二)欧盟EMA批准情况
截至2022年10月11日EMA官网披露,2022年1月至9月的推荐上市药品及新活性物质(NAS)数量情况见图2。2022年9月EMA未推荐药品上市。
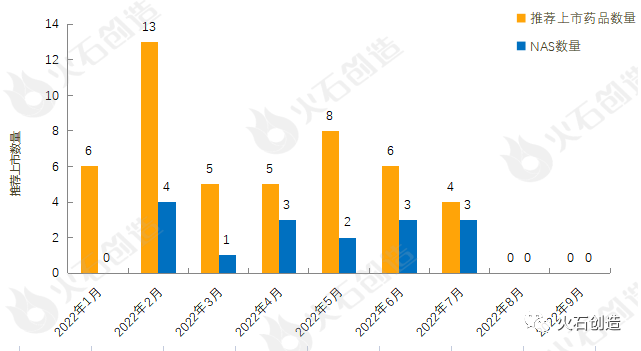
图2:22022年1—9月EMA推荐上市药品数量变化情况
来源:火石创造产业数据中心
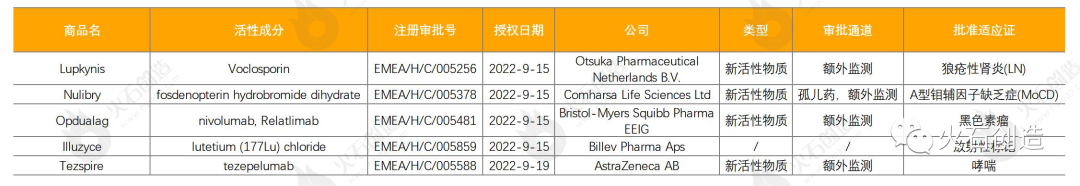
截至2022年10月11日,EMA在9月新授权5款药品上市,其中包括4款新活性物质,见表2。
Lupkynis是Aurinia Pharma公司开发、大冢制药授权合作的一款药物,也是美国和欧盟批准用于治疗狼疮性肾炎(LN)的首个口服药物,能显著改善肾脏应答;Nulibry是欧洲首个也是唯一一个治疗A型钼辅因子缺乏症(MoCD)患者的药物,是一种首创的cPMP底物替代疗法,于2021年获得FDA批准,其上市将为超罕见和进展性疾病A型MoCD患者带来治疗选择;百时美施贵宝公司的Opdualag由新型LAG-3阻断抗体relatlimab与PD-1抑制剂nivolumab(纳武利尤单抗)组成,是获得监管批准的首个LAG-3阻断抗体组合产品,用于一线治疗黑色素瘤;阿斯利康公司的Tezspire是一款首创(first-in-class)生物制剂,表现在适用于广泛哮喘患者,无表型/生物标志物限制。
表2:2022年9月EMA授权药物列表
来源:火石创造产业数据中心
(三)NMPA批准情况
截至2022年10月11日NMPA披露,2022年9月共批准国产首次注册药品52件。按剂型去重后,共37个药品品种(不同厂家生产同一药物按同一品种计算)。本月有2个品规(2个品种)1类创新药获批,属中药。2022年9月NMPA批准的1类创新药情况见表3。
表3:NMPA批准的1类创新药获批列表

来源:国家药品监督管理总局
广金钱草总黄酮是人福医药自主研发的中药创新药,是公司第三个获批的1类创新药。相对于目前临床多采用的外科碎石取石办法,广金钱草总黄酮可以减轻对身体的伤害,该药品的上市将为输尿管结石中医辨证属湿热蕴结证患者提供新的治疗选择。
(四)仿制药一致性评价情况
截至2022年10月11日CDE官网披露,CDE共承办药品一致性评价受理号4241个,2022年9月共新增承办69个受理号。截至2022年10月11日,共4776个品规上市药品通过一致性评价(包含视同通过2010个品规),本月共77个品规的药品通过一致性评价(包含视同通过5个品规),按剂型去重后,共53个药品品种。
目前一致性评价品种通过的注射剂共1732个品规(263个品种),本月过评药品中共计38个品规(22个品种)的注射剂。2022年1月至9月通过一致性评价数量见图3。
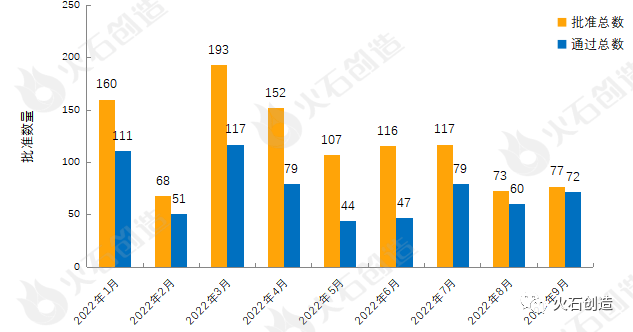
图3:2022年1—9月仿制药一致性评价批准数量变化情况
来源:国家药品监督管理总局
全球医疗器械获批情况
(一)美国FDA批准情况
截至2022年10月11日,9月FDA共批准284个510(k)途径的产品,其中一类器械23个,二类器械252个,未分类9个。
通过对510(k)上市前通知的器械根据美国医学专业用途进行分类,结果发现,9月产品获批类型最多的为一般和整形手术器械、骨科器械、放射科器械、一般医院和个人使用类器械与牙科器械,见图4。
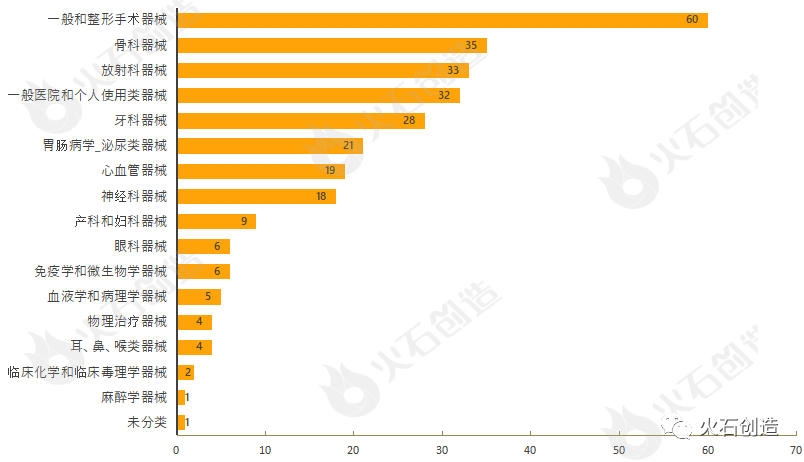
图4:2022年9月通过FDA 510(k)途径获批上市产品类型分布情况
来源:美国食品药品监督管理局
2022年9月有1个通过上市前批准(PMA)途径首次上市的产品。
表4:2022年9月PMA首次批准的器械

来源:美国食品药品监督管理局
(二)境内批准情况
截至2022年10月11日,2022年9月国家局公示了9个三类医疗器械进入创新审批绿色通道,见表5。
表5:2022年9月进入绿色通道的三类创新器械
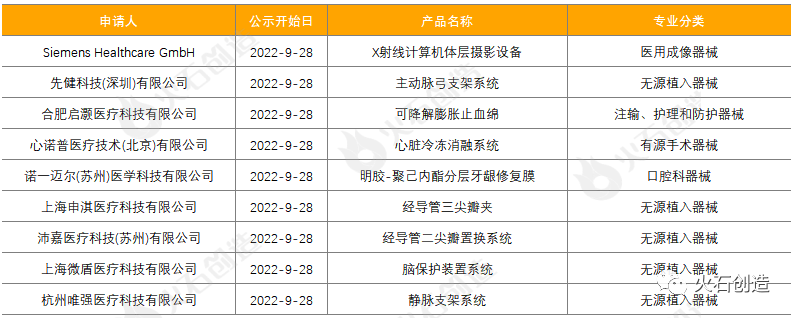
来源:国家医疗器械审评中心
截至2022年10月11日,2022年9月国家局公示了2个三类创新器械获批上市,见表6。
表6:2022年9月获批上市的三类创新器械
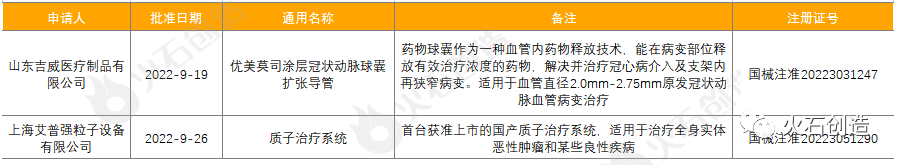
来源:国家医疗器械审评中心
截至2022年10月11日,2022年9月国家局共批准首次注册三类医疗器械产品187个,其中国产162个,进口25个。各省级药品监管部门9月共批准国产第二类医疗器械注册960个,一类备案医疗器械1496个。
统计数据显示,体外诊断试剂数量最多,共909项,占32.78%,基本上均为国产,为886项。除体外诊断试剂,批准注册类别数量排前三位的分别为注输、护理和防护器械,临床检验器械和口腔科器械。
表7:2022年9月国产、进口医疗器械批准注册类别数目分布情况
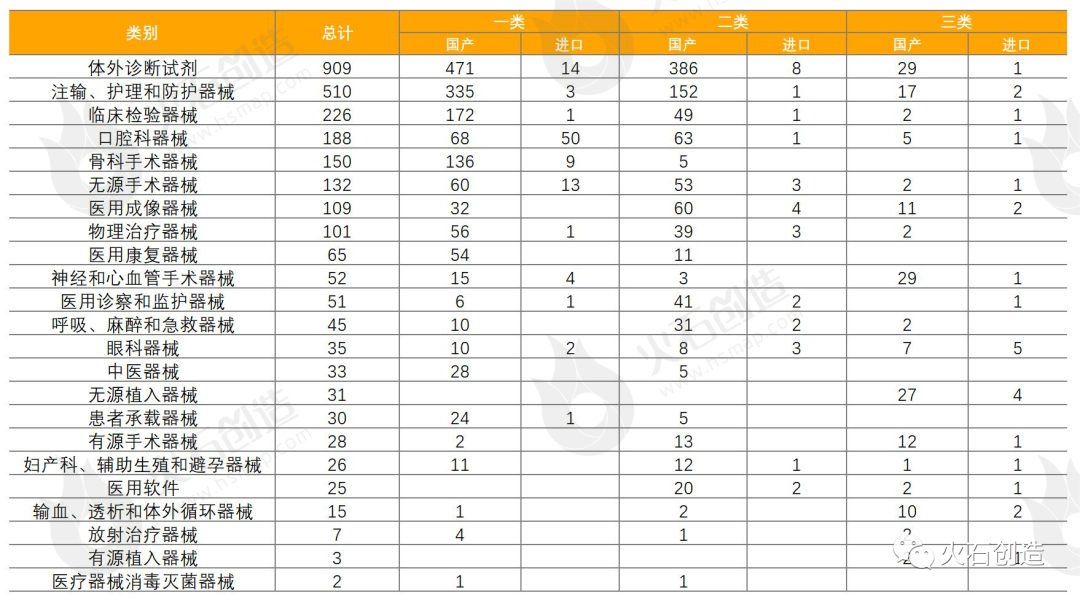
来源:国家医疗器械审评中心
从地域分布上,2022年9月国产二、三类注册产品批件最多的依次为广东省(250件)、湖南省(192件)、江苏省(168件)三个区域,见图5。
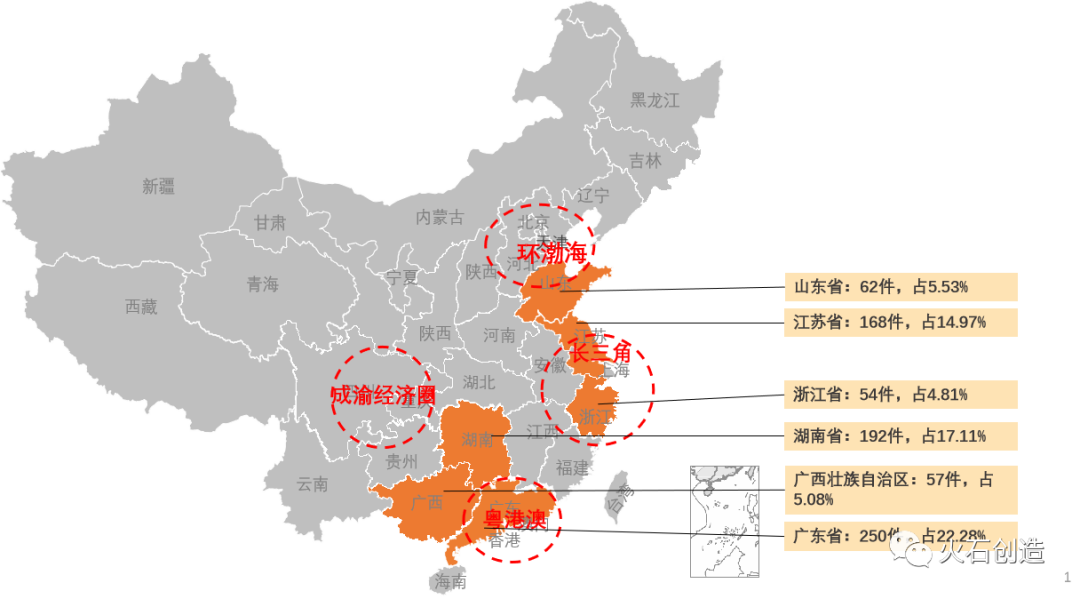
图5:国产获批器械区域分布