上半年16款创新药获FDA批准上市, 1款来自中国
来源:药事纵横 | 发布时间:2025-07-31
摘要:据统计,截至6月30日,今年上半年共有16款创新药获FDA批准上市,其中包括9款化药新药和7款生物药新药。从适应症来看,肿瘤药物仍占据获批数量之首,共有7款,涵盖肺癌、乳腺癌、鼻咽癌、卵巢癌等领域。此外,还有4款罕见病药物获批上市,适应症分别为遗传性血管水肿、血友病、神经纤维瘤、腱鞘巨细胞瘤。
整理如下:
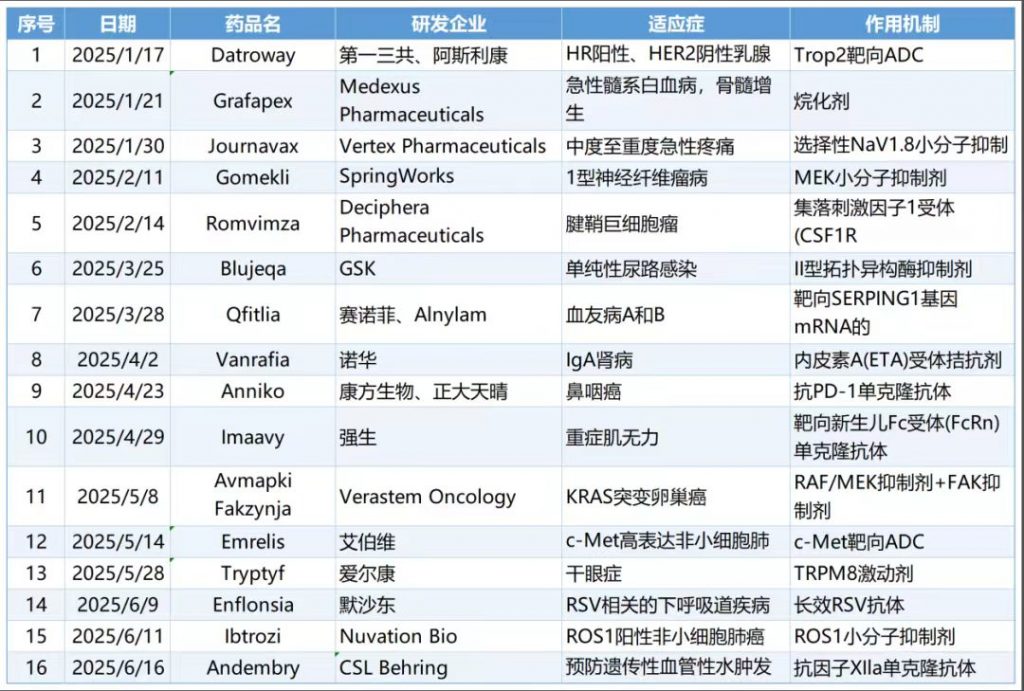
其中,有一款来自中国,即康方生物自主研发的PD-1单抗药物派安普利单抗注射液(商品名:安尼可®)在今年4月获美国FDA批准上市,用于治疗复发或转移性鼻咽癌(NPC)的一线治疗和以铂类为基础的至少一线化疗治疗进展后的2项适应症。派安普利单抗是由康方生物自主研发,并由康方生物与正大天晴负责后续开发和商业化。该产品是采用IgG1亚型并进行Fc段改造的PD-1单抗。其Fc段改造通过消除与FcγR的结合,避免了抗体依赖性细胞吞噬(ADCP)和细胞因子释放(ADCR),减少效应T细胞的非特异性耗竭,从而提升抗肿瘤活性并降低全身免疫毒性。值得注意的是,派安普利单抗不是第一个获FDA批准的国产抗PD-1单抗药物。2023年10月,君实生物的Toripalimab获得FDA批准用于鼻咽癌治疗;2024年3月,百济神州的tislelizumab也获FDA批准用于食管鳞状细胞癌。派安普利单抗是第三款获FDA批准的国产PD-1单抗。除此之外,上半年获FDA批准的产品还包括第一三共和阿斯利康的Datroway、艾伯维的 Emrelis两款ADC药物,以及Vertex Pharmaceuticals的Journavx、GSK的Blujepa、赛诺菲和Alnylam的Qfitlia、强生的Imaavy 、CSL Behring的Andembry等创新药。
Datroway
Datroway是一款由人源化、靶向TROP2的单克隆抗体与创新DNA拓朴异构酶Ⅰ抑制剂(Dxd)通过可裂解的四肽连接子偶联生成的ADC药物获批适应症为HR阳性、HER2阴性乳腺癌。
Emrelis
Emrelis由c-Met结合抗体、可裂解连接体和微管蛋白抑制剂MMAE有效载荷组成,以特异性和高亲和力结合靶向表达c-Met的肿瘤细胞,获批适应症为c-Met高表达非小细胞肺癌。是首个批准用于治疗c-Met过度表达的经治疗晚期NSCLC的疗法。
Qfitlia
Qfitlia是一种可治疗所有血友病类型的siRNA疗法。3月28日,FDA批准赛诺菲和Alnylam联合开发的siRNA疗法Qfitlia上市,用于预防或减少12岁以上血友病A和血友病B患者的出血事件。Qfitlia通过降低抗凝血酶水平,从而促进凝血酶生成,重新平衡止血功能并预防出血。其中在美上市的药物哪些有望登陆中国市场?据不完全统计,在已经公开国内上市进展的药物中,上述跨国药企的新药中至少有4款已进入我国药品审评阶段。其中,多款新药被我国纳入优先审评。强生的尼卡利单抗Imaavy(用于治疗全身型重症肌无力)已被国家药品监督管理局药品审评中心纳入优先审评,有望加速获批;诺华的IgA肾病新药阿曲生坦,已于2024年11月递交上市申请,并被纳入优先审评。此外,进展较快的还有赛诺菲及Alnylam共同研发的血友病新疗法Qfitlia,国家药品监督管理局药品审评中心已在2024年受理其上市申请,预计在中国的审批决定将在2025年下半年公布。