全面解析:ADC特性与制剂开发
来源:抗体圈 | 发布时间:2025-04-17
摘要:截至2024年12月,全球已有16种肿瘤治疗用ADC药物获批,超过370种在临床评估中,涵盖肿瘤与非肿瘤适应症。药明生物团队分析了商业ADC的配方策略,强调制剂处方对药物稳定性和商业化的重要性。已批准的ADC多为冻干粉,采用多种缓冲液和糖类稳定剂(如蔗糖、海藻糖),并通过表面活性剂(如PS80)提高稳定性。ADC开发面临CMC生产挑战,包括抗体、linker、payload的稳定性及偶联特性等,需综合考虑以确保药物的有效性、安全性和可制造性。随着技术进步,ADC正从冻干向液体制剂过渡,同时探索皮下给药等新途径。
截至 2024 年 12 月,全球监管机构已批准 16 种用于肿瘤治疗的 ADC 药物。此外,ADC 的治疗潜力不断扩大,目前有超过370种新型ADC候选药物正在进行临床评估,涵盖肿瘤和非肿瘤适应症。ADC多元化的发展也为CMC的生产带来了挑战,特别是制剂研究领域,一个合格的制剂处方,不仅能够保证活性药物成分的稳定性,而且对于ADC 转化为商业上可行的治疗药物也至关重要。近日,来自于药明生物的团队首次对商业 ADC 中采用的配方策略进行了全面分析,并且剖析了ADC 制剂开发中的独特技术挑战,同时为这些挑战提出了潜在的解决方案。
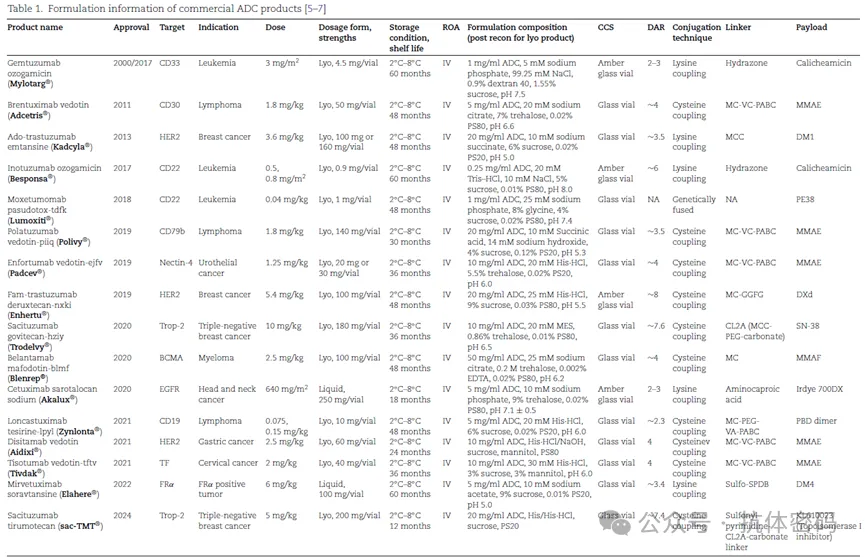
下表详细汇总了已经获批上市ADC药物的靶点,剂量,制剂处方,Payload等,这16种ADC药物中,14款为冻干粉,仅两款为液体制剂,给药方式都是通过静脉注射给药。使用多种缓冲液(磷酸钠、柠檬酸钠、组氨酸、MES等)。糖类稳定剂:最常用蔗糖(9种)、海藻糖(5种),其他稳定剂如甘露醇、甘氨酸、右旋糖酐40。表面活性剂:主要使用PS80(11种)和PS20(4种)。pH范围:5.0-8.0,多数偏酸性(pH 5.0-6.5)。药物抗体比(DAR):2-8不等,多数在3-4之间。偶联技术:半胱氨酸偶联(10种)最为常见,另外还有5款药物采用赖氨酸偶联。
下图总结了从早期到商业化的ADC药物配方开发和生产路线图,主要分为四个阶段,1)制剂处方的预筛选,该阶段主要关注成药性;2)临床前和临床制剂开发,该阶段主要考虑给药方式,给药剂量,辅料等;3)临床三期及上市,该阶段主要关注制剂的生产,工艺标准等;4)上市后稳定性研究。

可开发性
可开发性是指一款ADC药物是否可以顺利通过CMC并最终成为一款安全、有效和可制造的药物。对ADC进行成药性评估不仅要考虑抗体端的性质(包括抗体的均一性,溶解性,热稳定性特异性)还要考虑linker-payload的物理化学性质。同时,也需要考虑ADC药物整体的物理化学性质,包括粘度、溶解度、熔融温度、等电点和疏水性。并且这些性质可以通过linker-payload进行调整,因此在药物的开发过程中需要更具治疗方向及给药方式对其中的一些性质进行调整。例如 ADC皮下制剂 sacituzumab govitecan (IMMU-132) 和相关化合物(IMMU-130 和 IMMU-140)的开发受到浓度依赖性挑战的限制,包括蛋白质聚集和沉淀,这限制了可实现的最大给药。为了应对这些挑战,早期成影性评估可以采用高通量筛选方法,对多个候选药物进行有效评估并选择最优的候选分子。
给药途径
在 ADC 制剂的开发过程中,需要仔细考虑患者的依从性、临床疗效和安全性。抗体给药不像小分子药物依赖于肠道给药,其给药方式主要包括静脉内(IV)输注、皮下 (SC) 注射、静脉推注、玻璃体内和肌内给药。所有已批准的 ADC 均适用于肿瘤适应症,并且需要在医院完成静脉输注给药。目前,由于有效载荷的局部沉积和毒性,其他递送途径很少应用于临床晚。数据显示,正在进行的 ADC 研究中 55% 针对实体瘤,44% 侧重于血液系统恶性肿瘤,1% 探索非肿瘤适应症。然而,随着用于慢性病的 ADC 和用于抗肿瘤药物的 SC 递送的发展,SC 给药是 IV 注射最有吸引力的替代方案,因为它具有多种优势,例如自我给药、减轻治疗负担、提高患者依从性、减少输液相关反应以及治疗静脉通路不良的患者。

剂型和剂量
考虑到静脉给药是生物药物的主要递送途径,液体制剂是首选,因此市场上约三分之二生物药物都是注射产品,另外其比冻干药品成本更低,使用更方便。然而,与冻干版本相比,液体或冷冻液体形式的ADC 制剂可能会遇到更多的稳定性问题和更短的保质期。16个上市的ADC产品中14个为冻干制剂,两个为液体制剂。新的linker-Payload技术的进步以及对linker、ppayload和抗体成分的更好理解,使 ADC 开发人员能够采用明智的配方策略来确定ADC的剂型。这一进展可以促进从冻干产品到液体制剂的过渡,而不会显著延迟产品开发时间表.
用于ADC的赋形剂
ADC汇总表里统计了目前上市的ADC的制剂处方中常用的辅料,包括缓冲系统和表面活性剂。已经上市ADC处方的pH 值范围在5.0–8.0之间,缓冲系统如组氨酸、MES、柠檬酸盐、磷酸盐、Tris、琥珀酸盐和乙酸盐等。不同缓冲系统及pH需要和ADC进行匹配,如Mylotarg® 和 Besponsa® 分别采用磷酸盐(pH 7.5)和 Tris(pH 8.0)缓冲液,用于保护其linker中的酸敏感腙键。同样的Trodelvy®采用pH 依赖性裂解的碳酸盐基linker CL2A,因此其制剂采用相对较高的pH 值(pH 6.5)以提高稳定性。虽然乙酸盐缓冲液在液体制剂的低pH范围内表现出有效的缓冲能力,但它们的挥发性和潜在的升华限制了它们在冻干产品中的应用。溶出保护剂,特别是二糖,可以在水溶液和冻干过程中稳定蛋白质。在ADC配方中添加表面活性剂(例如 0.1–2 mg/ml 的聚山梨酯 20 或 80),以消除气-水界面处或机械应力下的变性。抗氧化策略包括补充蛋氨酸以清除游离硫醇,以及螯合剂,如乙二胺四乙酸和二乙烯三胺五乙酸,以抑制金属催化的不稳定。
无论是在商业产品中还是在临床阶段候选药物中,冻干仍然是大多数ADC首选的配方,因为它能够保持偶联物的完整性并最大限度地减少有效载荷在储存过程中过早释放。然而,冻干过程会产生冷冻和干燥应力,例如溶质浓度、冰晶的形成和 pH 值变化,这些应力会使蛋白质在不同程度上变性。因此,应在 ADC 制剂开发的早期阶段仔细选择适合冻干制剂的辅料。一般来说,离子赋形剂会降低制剂的玻璃化转变温度(Tg’),因此不推荐或保持在最低水平,而具有中等和耐受 Tg’ 值的二糖经常用作冻干保护剂。
同时,随着皮下 ADC 制剂在临床上的进展,未来的发展可能需要低粘度赋形剂(例如离子盐、氨基酸如精氨酸、甘氨酸、脯氨酸和赖氨酸或咖啡因)以及重组人透明质酸酶来优化药物递送。
ADC不同组件的稳定性
由于ADC的结构复杂性,应考虑制剂开发过程中潜在的特异性稳定性问题,以确保 ADC 产品的疗效。如下图所示,可以从不同的角度进行 ADC 稳定性分析,包括linker、有效载荷和 mAb 组分的稳定性以及整个偶联组装体的稳定性。
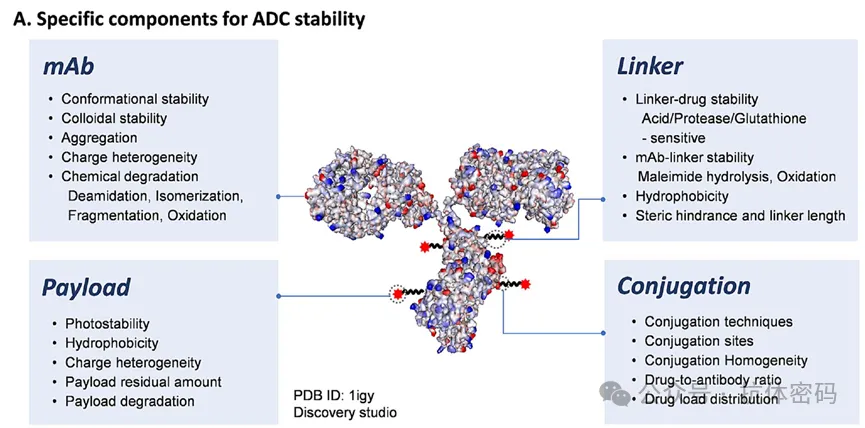
抗体(mAb):在 ADC 分子中,mAb 组分代表生物靶向剂,并用作蛋白载体将药物递送到特定部位。尽管 ADC 和 mAb 具有相似的二级和三级结构,但相对于 mAb 而言,ADC 的构象稳定性和胶体稳定性通常较低,并且ADC的熔化温度较低。此外, ADC分子中偶联位点周围更多的疏水表面,其更倾向于聚集]。就蛋白质而言,尤其是ADC,其盐析(增加溶解度/降低溶解度)会受到配方开发中离子强度的影响。离子浓度升高会减弱电荷排斥力,可能会促进蛋白质-蛋白质的吸引力,从而降低胶体稳定性——这种关系可以通过kD和 B22 等参数来量化。与裸 mAb类似,偶联的mAb组分容易受到化学降解途径的影响,如脱酰胺、异构化、碎裂和氧化,具体取决于 pH/缓冲液环境。这些类型的降解导致疏水性、电荷异质性或聚集的变化,如果在CDR区,可能会影响产品效力。
Linker
Linker连接 mAb 和payload,因此它在体内循环时应该具有足够定性,同时在适当的条件下裂解并释放payload。因此,ADC 稳定性会受到设计接头的化学性质或接头相关不稳定性的显著影响,其可以细分为linker-payload不稳定性和 mAb-linker不稳定。下表总结了已获批 ADC 产品的偶联技术和接头稳定性研究。如下表所示,根据ADC的体外稳定性数据,无论是不可切割的还是可切割的linker,已批准的 ADC都具有一定程度的与llinker相关的不稳定。
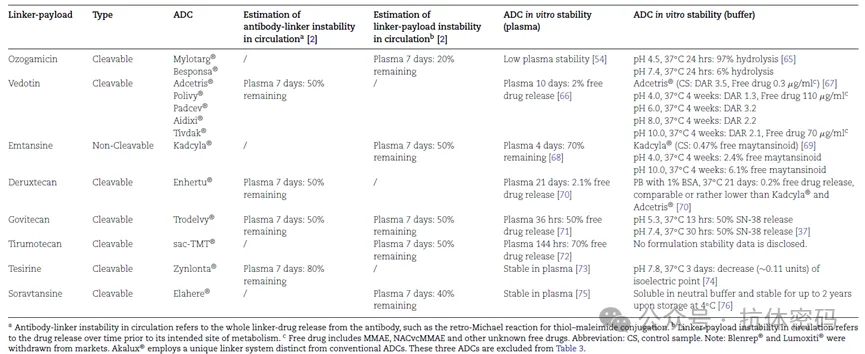
在体外和体内观察到的琥珀酰亚胺环水解和马来酰亚胺交换仍然是 ADC 的关键质量问题。到目前为止,16 种市售 ADC 中有 10 种采用半胱氨酸-马来酰亚胺 Michael反应进偶联。巯基-马来酰亚胺接头中的琥珀酰亚胺环易通过水解发生开环反应,尤其是在高 pH 值和高温。虽然水解琥珀酰亚胺不会触发逆Michael 交换或过早的释放payload,但它会引入额外的电荷异质性。为了解决该问题,可以利用PEG基团、碱性胺、芳基环、二恶烷部分和可变长度的碳链被战略性地放置在马来酰亚胺基团附近进行结构修饰,以加快水解速率。
Linker的氧化也是ADC稳定性需要关注的问题,有研究报道,硫醚琥珀酰亚胺linker在温和的水环境中被氧化,然后被亚砜消除,特别是在过氧化氢(H2O2),高pH和温度的存在下。
在较差的体内循环环境中,空间位阻提供了良好的物理保护。例如,在没有游离巯基的情况下,二硫键接头在生理 pH 值下热力学上是稳定的。通过在二硫化物附近引入两个甲基以放大空间屏蔽,可以进一步稳定二硫键。此外,相对于较长的接头,较短的接头通常通过将payload进一步屏蔽在抗体的局部构象内而具有更好的ADC稳定。
为了在一定成都上解决payload的疏水性,亲水性连接子设计可以使抗体携带更多的疏水性ppayload,而不会引发聚集或失去亲和力。该设计策略整合了几个关键元素:亲水性部分(β-葡萄糖醛酸,聚乙二醇间隔物),带电荷基团(磺酸盐,磷酸/焦磷酸),末端极性残基(牛磺酸,氨基,和糖基),以及优化的二肽间隔物(Ala-Ala/Gly-Glu作为Val-Cit/Val-Ala的替代品),这使得ADC具有更高的溶解度。
Payload
ADC 和mAb之间的根本区别之一是存在payload。因此,在制剂配方开发过程中应考虑有效载荷特有的几种与稳定性相关的特性,例如光稳定性、疏水性和payload降解。payload发生光降解,从而影响药物的整体稳定性,这是 ADC 分子的一个常见问题。获批的mAb产品通常包装在透明小瓶中,而FDA批准的三种市售ADC药物(Mylotarg、Besponsa 和 Enhertu)和PMDA批准的ADC 药物(Akalux)则采用琥珀色小瓶包装。Payload如钙菌霉素、exatecan、蒽环类、双胞胎霉素、卟啉、氯和细菌氯等都存在一些光敏集团,同样,喜树碱及其衍生物表现出显著的光降解特性,当暴露于实验室照明或阳光下时,特别是在中性和碱性条件下,会形成浑浊的黄色溶液并伴有可见沉淀。
除了光降解外,ADC 有效载荷上也经常观察到 pH 依赖性和温度敏感(8℃、25℃、40℃)降解,较高的温度和较低的 pH 值会导致更严重的降解。ADC 降解可能会导致不必要的和意外的毒性,从而可能影响治疗效果和患者安全。
疏水性是小分子药物最重要的理化性质之一,与体外效价增强、溶解性差、代谢不稳定和非特异性脱靶效应高度相关。在 ADC工艺开发阶段观察到有效载荷依赖性结构不稳定和payload疏水性增加驱动的自聚集倾向增强。对于小分子药物,疏水性增加会带来水溶性差的风险。对于 ADC 分子,实验证明linker-payload疏水性是导致聚集的重要因素,但不是 ADC 不稳定的唯一驱动因素。
偶联特性
除了上述介绍的药物结构的影响,抗体偶联的特性对和均一性也对CMC 质量控制至关重要。偶联特性包括采用的偶联技术、偶联位点、药物抗体比 (DAR) 值和药物负载分布都会影响多种生物物理特性,对这些因素进行严格表征对于确保批次一致性和治疗性能至关重要。随着研究的进展,目前已经有多种偶联技术,赖氨酸-酰胺偶联、半胱氨酸-马来酰亚胺烷基化、非经典氨基酸工程、二硫键再桥接以及酶偶联,糖偶联等。研究表明,与链间半胱氨酸偶联物相比,基于赖氨酸的偶联物显示出更大的搅动诱导聚集性。基于非天然氨基酸的位点定点偶联表现出高均一性、稳定性和更长的半衰期。
另外DAR值和药物负载分布对 ADC 产品质量至关重要,研究表明,由于盐析效应和增强的疏水相互作用,具有较高 DAR值的ADC可能更容易在盐环境中形成可溶性和不溶性聚集体。
总结
作为一种创新的药物模式,ADC 在肿瘤治疗领域具有巨大的临床价值和市场潜力。这篇综述重点介绍了 ADC 制剂开发的基本特性和主要关注领域,以及制造和运输过程中(见原文)的要点。全面了解ADC的特性,不仅能够保证设计出具有高活性的药物,而且能保证其在后续的生产中也能保持稳定,从而能够在上市后持续的给患者提问有效的药物。