我国改良型新药申请情况分析与思考
来源:医药地理 | 发布时间:2024-02-29
摘要:自2015年实施药品审评审批改革以来,我国陆续出台了一系列促进新药发展的政策,改良型新药的申报数量不断增加。改良型新药是指在已知活性成分的基础上,对其结构、剂型、处方工艺、给药途径、适应证等进行优化,且具有明显临床优势的药品,是当前新药研发的热点方向之一。根据CPM新药研发监测数据库显示统计,2020年全年CDE共受理2类化学药品生产/上市注册申请324件(按受理号计),2021年共受理生产/上市注册申请427件,2022年共受理生产/上市注册申请426件,2023年共受理生产/上市注册申请为569件,申请量总体呈上升趋势。2023年受理的569件申请中,其中,国产药424件,进口药145件;新药552件,仿制药17件;临床申请409件,上市申请72件,补充申请88件。申请类型为“新药”的共394件,“进口”87件,“补充申请”88件,注册分类集中在2.2类(2269件)和2.4类(22166件)。
今年2月初,国家药监局药审中心发布了《化学药改良型新药临床药理学研究技术指导原则(试行)》,强调了临床药理学在改良型新药研发中的重要性,为开展相关研究提供了详细的指导和规范,有助于确保研究的科学性和规范性。
自2015年实施药品审评审批改革以来,我国陆续出台了一系列促进新药发展的政策,改良型新药的申报数量不断增加。改良型新药是指在已知活性成分的基础上,对其结构、剂型、处方工艺、给药途径、适应证等进行优化,且具有明显临床优势的药品,是当前新药研发的热点方向之一。
一、历年总量
根据CPM新药研发监测数据库显示统计,2020年全年CDE共受理2类化学药品生产/上市注册申请324件(按受理号计),2021年共受理生产/上市注册申请427件,2022年共受理生产/上市注册申请426件,2023年共受理生产/上市注册申请为569件,申请量总体呈上升趋势。
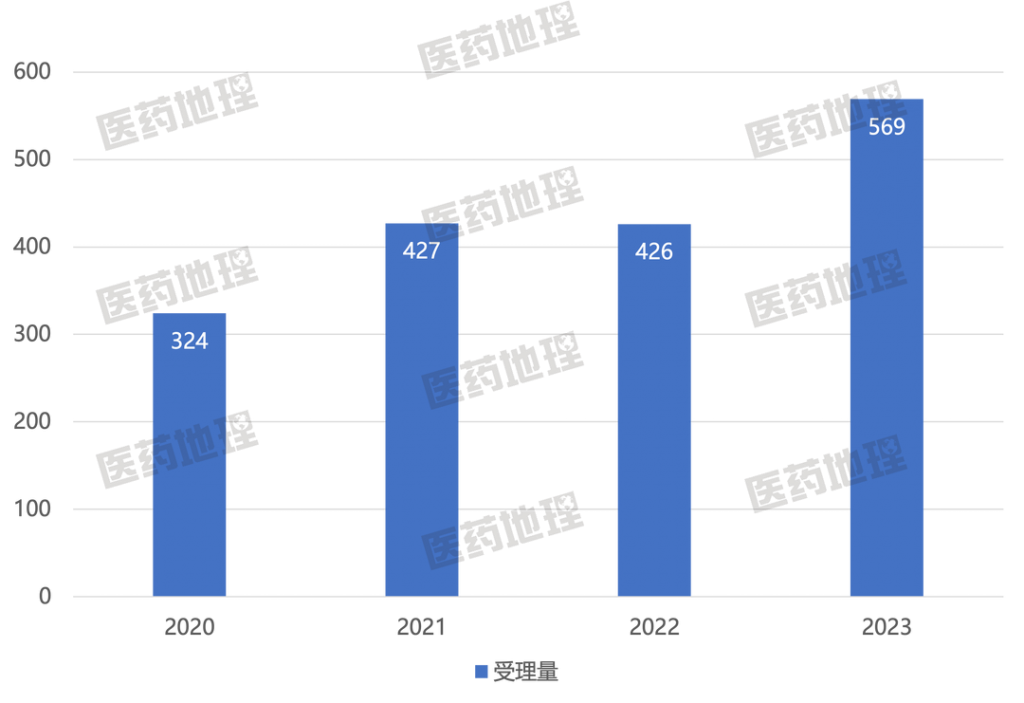
图1: CDE 2类化学药品注册申报受理
信息来源:CPM新药研发监测数据库,中国医药工业信息中心
我国正积极推进从制药大国向制药强国的转变,鼓励医药企业从仿制药向创新药的转型。在新药靶点开发日益困难的情况下,改良型新药为积极转型的仿制药企业带来了新的发展机遇。相对于全新靶点和结构的创新药,改良型新药具有更低的研发成本、更短的研发周期和更好的市场适应性,符合国医药企业转型升级的方向,因此吸引了不少企业切入。
二、注册分类
根据《国家药监局关于发布化学药品注册分类及申报资料要求的通告》,化学药改良型新药注册分类分为以下4种。
2.1 含有用拆分或者合成等方法制得的已知活性成分的光学异构体,或者对已知活性成分成酯,或者对已知活性成分成盐(包括含有氢键或配位键的盐),或者改变已知盐类活性成分的酸根、碱基或金属元素,或者形成其他非共价键衍生物(如络合物、螯合物或包合物),且具有明显临床优势的药品。
2.2 含有已知活性成分的新剂型(包括新的给药系统)、新处方工艺、新给药途径,且具有明显临床优势的药品。
2.3 含有已知活性成分的新复方制剂,且具有明显临床优势。
2.4 含有已知活性成分的新适应证的药品。
2023年受理的569件申请中,其中,国产药424件,进口药145件;新药552件,仿制药17件;临床申请409件,上市申请72件,补充申请88件。申请类型为“新药”的共394件,“进口”87件,“补充申请”88件,注册分类集中在2.2类(2269件)和2.4类(22166件)。
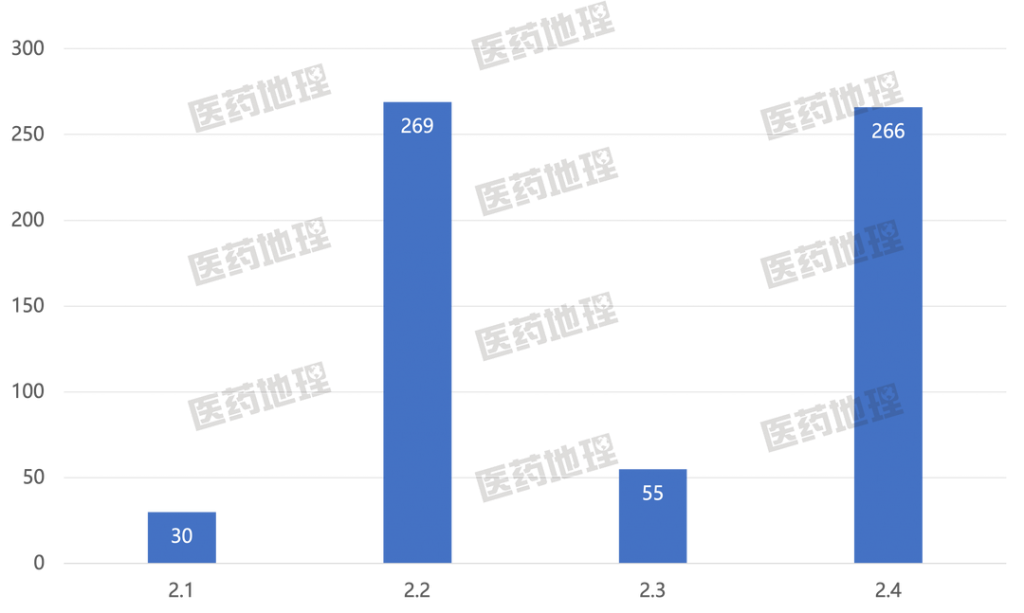
图2: 2023年CDE药品注册申请注册分类分布
来源:CPM新药研发监测数据库,中国医药工业信息中
申报和批准数据主要以2.2和2.4类为主,2.1类和2.3类数量较少,其主要原因在于不同改良方向的难易有别,研发成本上也存在一定的差异。
2.2类改良型新药主要对剂型、工艺进行改进,通过新剂型的优势体现临床优势,不改变药理活性,相对较为简单,具有明确的临床优势,很多改进不需要做大规模临床试验,只需要通过生物等效性试验证明其药动学一致,因此成本较低;2.4类改良型新药将新适应证作为改良的方向,多数为创新药的新增适应症。
2.1类和2.3类改良型新药申报和批准的数量较少,一方面是技术原因,目前国内药企研发实力仍有待提高,只有极少数药企具有开发这类新药的能力;另一方面这二类新药必然需要做大规模临床研究以证明其安全性和有效性,研发时间长、风险相对较大、研发成本高。
三、治疗类别
从治疗类别来看,排除部分治疗类别暂时不明的申请,受理号数量排在前五的依次是抗肿瘤药、心血管系统用药、呼吸系统药物、精神障碍用药和内分泌及代谢调节用药,这些领域占总申报量的47.63%。
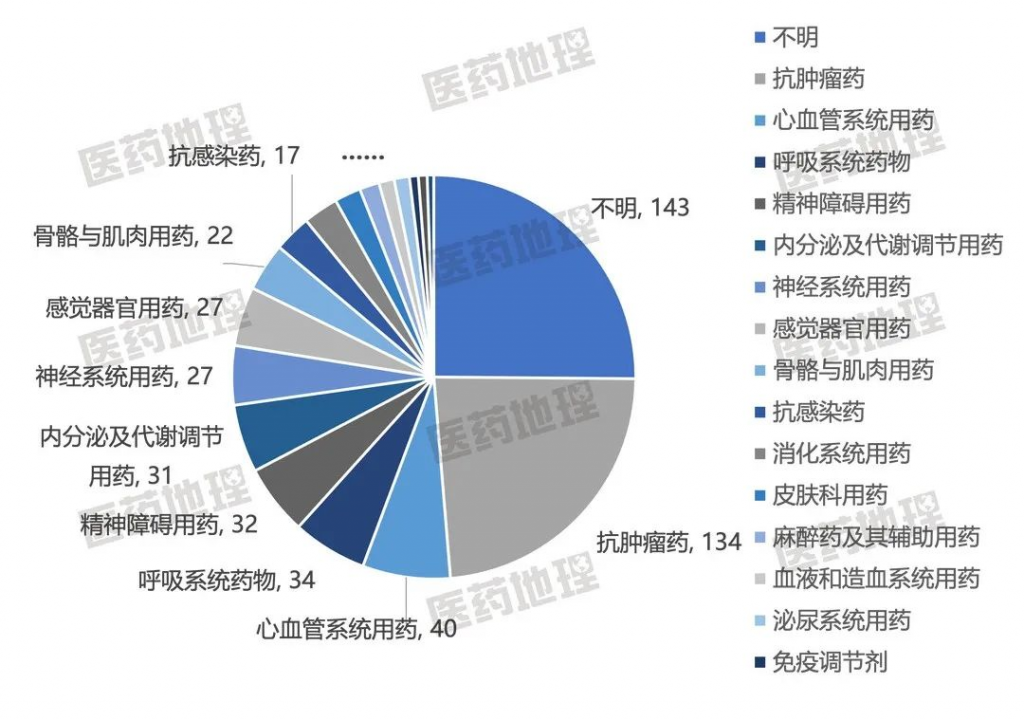
图3: 2023年CDE受理2类化药涉及治疗类别TOP10
来源:CPM新药研发监测数据库,中国医药工业信息中心
2021年《“十四五”医药工业发展规划》中提出要重点发展针对肿瘤、自身免疫性疾病、神经退行性疾病、心血管疾病、糖尿病、肝炎、呼吸系统疾病、耐药微生物感染等重大临床需求的化学新药。抗肿瘤药不仅是我国化学药改良型新药的研究热点,也是政策支持的导向。
此外,新研发的抗肿瘤药满足治疗某一种肿瘤的条件即可申报上市,但随着研究深入和治疗时间延长后,发现对其他肿瘤也有效,于是药企会以此作为改良的新适应证再次申报,也会导致抗肿瘤药申请数量较多。
由此可以得出药企探索的两个思路:① 抗肿瘤药物研发成功率较高,且符合政策导向,药企可以继续在该领域深入研究改良型新药的研发。② 抗肿瘤药物已成为研发热门,竞争激烈度较大,为避免领域过于饱和,药企也可以另辟蹊径,去探索研发其他冷门治疗领域的改良型新药。
四、申请企业分布
下图为2023年提交申请数量大于10件的企业及其申请涉及药品通用名。正大天晴药业集团股份有限公司共提交申请35件,其中30件涉及抗癌药物安罗替尼。江苏恒瑞医药股份有限公司共提交申请20件,涉及达尔西利(抗肿瘤药)、恒格列净(内分泌及代谢调节用药)、布比卡因(麻醉药及其辅助用药)等药物。申请量排名前10位的企业(10/227,4.41%)共提交申请136件,占全部申请量23.90%,头部效应较为显著。

图4:2023年提交申请数量大于10件的企业及其申请涉及药品通用名
来源:CPM新药研发监测数据库,中国医药工业信息中心
五、剂型
根据剂型对2.2类化学药申请临床试验的数据进行统计,改良后的剂型为口腔膜剂、注射剂和缓释片的数量位列前三。表1: 2.2类化学药申请临床试验剂型统计

来源:CPM新药研发监测数据库,中国医药工业信息中心
从上述剂型统计可以看出,申请临床的2.2类改良型新药中,改良后的剂型有不少属于高端制剂。高端制剂通常具有改变药物的作用方式和速度、影响药物疗效、降低药物毒性等特点,符合改良型新药所要求的“具有明显临床优势”,与改良型新药的要求契合度较高。因此,利用高端制剂技术作为2.2类改良型新药的切入口是一条可行之路。
基于国家的政策法规向创新药的倾斜,国家带量采购、仿制药一致性评价、医保控费等医改政策高压下,仿制药的利润逐年下降,越来越多的医药企业争相涌入创新药赛道。但是由于新药物新靶点开发时间长、风险大、成本高,多数仿制药企业选择以改良型新药作为转型升级的突破口,在完全创新和仿制之间开辟出一条新赛道。