License out的中国创新药盘点
来源:医药魔方 | 发布时间:2024-02-29
摘要:近年来,以ADC赛道为代表的中国创新药License out交易爆发,无疑是对我国创新药实力最好的肯定。但交易达成只是国产创新药商业价值兑现的一小步,后续临床开发、监管批准、商业化上市无不决定着一款药物的结局和成败。本文在此盘点这些年中国license out出去的项目的海外开发进度供参考。
近年来,以ADC赛道为代表的中国创新药License out交易爆发,无疑是对我国创新药实力最好的肯定。但交易达成只是国产创新药商业价值兑现的一小步,后续临床开发、监管批准、商业化上市无不决定着一款药物的结局和成败。本文在此盘点这些年中国license out出去的项目的海外开发进度供参考。
在欧美成功获批的还是少数
目前,国内仅有传奇生物、君实生物、和黄医药和亿一生物通过license out在海外药企的助力下叩开了FDA的大门,成功拿到欧美医药市场的入场券。
license out之后在美国上市的国产新药

西达基奥仑赛是传奇生物开发的一款BCMA CAR-T细胞疗法,在立项之初便瞄准了国际市场。2017年6月凭借100%的客观缓解率,该产品在ASCO会议上一鸣惊人。亮眼的I期临床数据迅速吸引了强生的目光,经过充分的尽调和谈判,同年12月双方达成合作,共同开发、生产和商业化西达基奥仑赛。
2022年2月,西达基奥仑赛不负众望顺利在美国上市,成为首款成功出海的国产创新细胞疗法,随后又相继在欧盟、日本等地区斩获批准,国内多发性骨髓瘤的上市申请也正在审评审批中。作为同类最佳产品,西达基奥仑赛2023年首个自然年便大卖5亿美元,未来随着前线治疗适应症的推进和产品的扩充,市场潜力更是不容小觑。
与西达基奥仑赛率先在海外市场获批不同,特瑞普利单抗、艾贝格司亭α、呋喹替尼是首先在国内上市,2023年下旬才相继拿到FDA的门票,迎来了中国出海新药集体收获的首个时刻。临床数据过硬、适应症选择合适、研发进度靠前和市场格局良好等因素是这些产品闯美成功的共性。
以特瑞普利单抗为例,该产品闯关成功之前,其实已有多款PD1或折戟于FDA,或被退回权益,出海希望渺茫。特瑞普利单抗之所以能够脱颖而出,就在于差异化独家布局了鼻咽癌适应症并且疗效和安全性的临床数据出色。
“退货”在交易数量增多后逐渐成为常态
国产创新药license out在数量和金额持续走高的同时,也出现了不少买卖双方联盟破裂的案例。据医药魔方不完全统计,自2014年起发生的交易终止事件已经超过20起,其中包括多起总金额超过10亿美元的重磅license out交易。
国产创新药license out交易终止名单
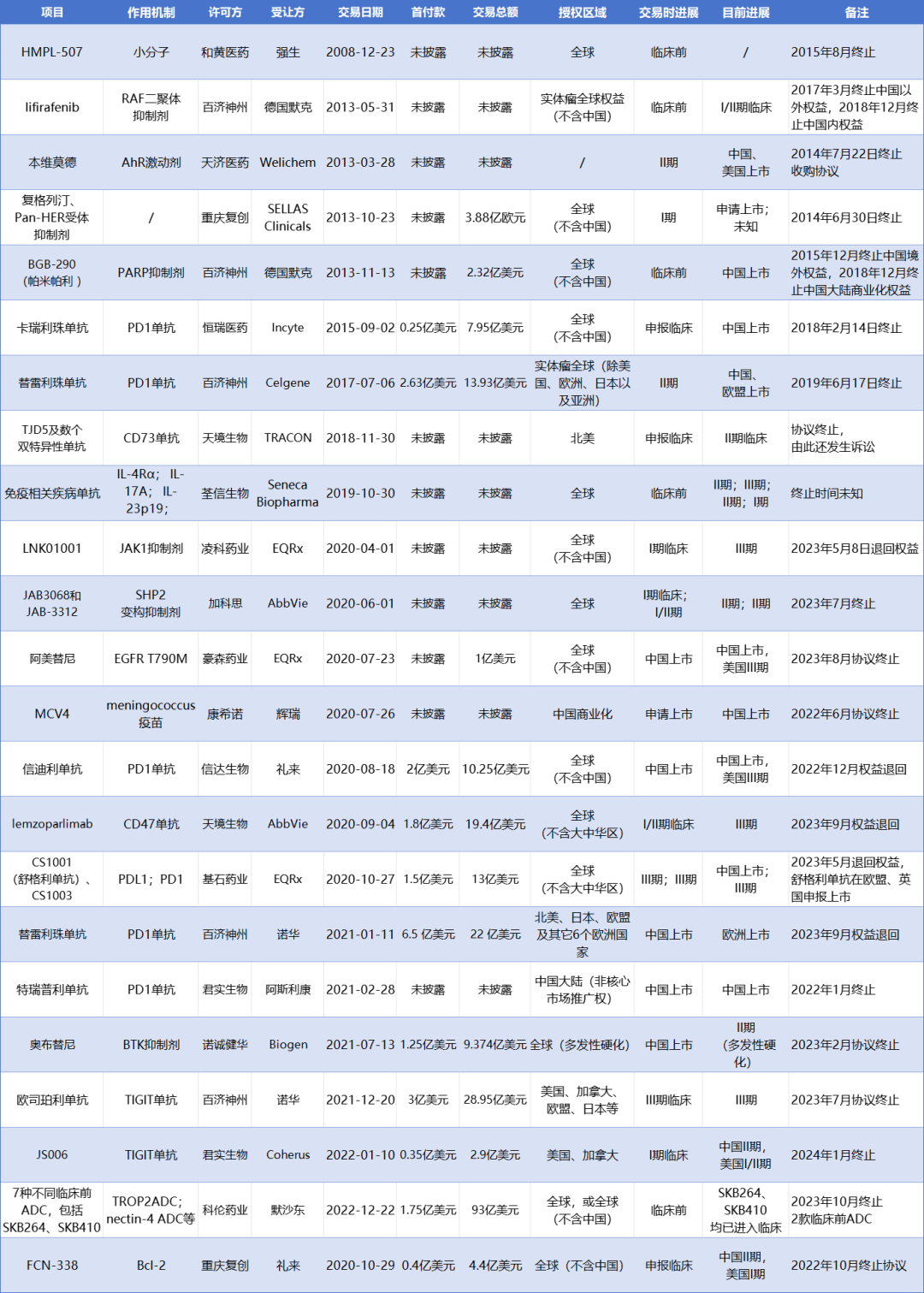
当技术或靶点火热时,海外药企尤其是MNC财大气粗,往往会用少许首付款换得“看牌权”,以此来入局和降低进入这一赛道的上场成本。但当产品更多概念验证数据读出、外部市场竞争环境发生变化或者公司战略进行调整时,将产品权益退回也是常见现象。从上述交易达成和终止的时间来看,受让方一般在引进后两到三年经过选择退回权益。
2020年CD47靶点高光时刻到来时,艾伯维从天境生物花费1.8亿美元首付款引进了lemzoparlimab(来佐利单抗)。但该靶点后续临床开发并不顺利,由于存在安全性和疗效问题,Arch Oncology、ALX Oncology、吉利德等先行者多项临床研究被暂停,期间艾伯维也终止了lemzoparlimab治疗多发性骨髓瘤等疾病的临床试验。面对潜在的失败风险,艾伯维痛定思痛之下选择及时止损,在2023年9月退回了lemzoparlimab的权益。
TIGIT也是一个命运多舛的靶点。2020年,罗氏tiragolumab以一己之力拉高了业内人员对该靶点的预期。但后来tiragolumab多项研究失败,BMS由于毒性问题终止BMS-986207开发,接连不断的负面消息为TIGIT的前景蒙上了阴影。在这种情况下,欧司珀利单抗和JS006权益相继被退回。
疗效和安全性问题固然是导致“退货”的原因之一,但更多交易终止是因为战略调整、管线冲突、监管受阻、市场格局变化等。比如百济神州在BMS完成收购新基前主动收回替雷利珠单抗全球权益,信达生物的信迪利单抗在美国上市受阻而被礼来退回,凌科药业的JAK抑制剂LNK01001则是因EQRx公司战略调整被退回。而针对被退回的产品,国内药企普遍选择自己推进,当然也有企业会选择在时机合适时再次将权益转让出去。
结语
由于外部环境瞬息万变,创新药开发充满不确定性,license out本就不可能一路坦途。随着越来越多国产新药被授权出去,“退货”也势必会成为行业常态,尤其是还未有同类产品得到临床和市场验证的药物。不过目前我国大部分license out新药还处于推进阶段,结局是大获全胜还是无功而返,或许要到两三年后才能明晰。