mRNA肿瘤疫苗的研发进度与展望
来源:eMedClub News | 发布时间:2024-01-10
摘要:随着近年来对肿瘤生物学理解的不断深入,基因组学和蛋白质组学等先进的医疗技术已经成为最新突破和开发新型诊断和治疗方案的关键,特别是肿瘤特异性的靶点或表位,以及多样化的生物标志物的发现,对于mRNA癌症疫苗的开发有重大意义。本文将结合近日华西医院发表在Trends in immunology的综述,对mRNA肿瘤疫苗免疫疗法的近期进展与未来趋势进行浅析。
随着近年来对肿瘤生物学理解的不断深入,基因组学和蛋白质组学等先进的医疗技术已经成为最新突破和开发新型诊断和治疗方案的关键,特别是肿瘤特异性的靶点或表位,以及多样化的生物标志物的发现,对于mRNA癌症疫苗的开发有重大意义。本文将结合近日华西医院发表在Trends in immunology的综述,对mRNA肿瘤疫苗免疫疗法的近期进展与未来趋势进行浅析。
科技成果的转化总是面临重重挑战,但“办法总比困难多”。目前,通过化学修饰增强mRNA的稳定性和翻译,同时减少先天免疫响应已是业内共识;打造新型递送平台不仅可以保护mRNA免于降解并促进细胞摄取和内体逃逸,还具有佐剂活性,可以增强免疫反应而无全身毒性。LNP是目前研究最深入、临床最成熟的载体,辉瑞/BioNTech的BNT162b2和Moderna的mRNA-1273新冠疫苗均采⽤LNP形式。与阳离⼦脂质相⽐,可电离脂质可以根据环境酸碱性改变其状态,便于封装及在体内延长半衰期,并提高翻译效率及稳定性。聚合物基纳⽶颗粒和⽆机纳⽶载体的优势在于其卓越的稳定性,⽽ DC 和 EV 则在免疫调节能⼒和⽣物相容性上更胜一筹。VLP、外泌体、GalNAc、SORT-LNP等新型非病毒载体全面开花,如何扬长避短的取舍。
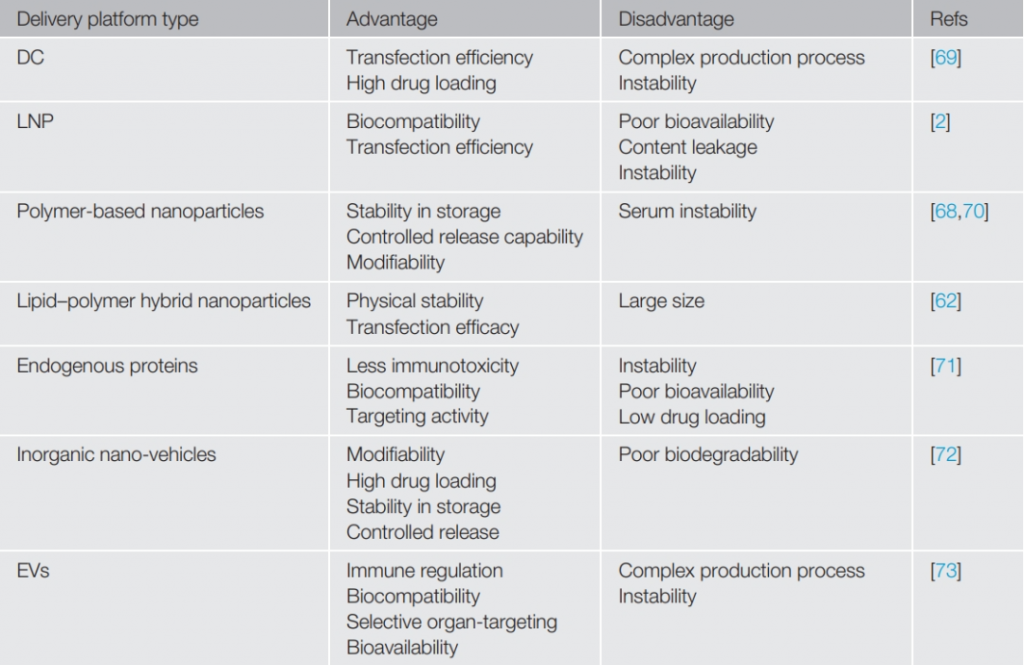
▲不同递送载体的优劣势
除了在递送载体的种类上下功夫,对淋巴及肝外组织的靶向研究也是进行的如火如荼。今年,仅就LNP的特异性靶向方面就有靶向胎盘、骨髓组织、胰腺等多种器官的研究层出不穷。麻省理工Daniel Anderson 团队还开发了迄今最高效的向肺部递送mRNA的雾化脂质纳米颗粒(LNP)配方,为肺部疾病的基因治疗带来了更有潜力的递载体。

除了常规的化学修饰和靶向递送“两手抓”之外,想要让更多患者受益,免疫逃逸也是亟待解决的问题。纳米载体技术和分析测序技术的发展也给可以增强抗原呈递的个性化mRNA疫苗开发带来了突破性进展。通过对肿瘤生物学及免疫抑制肿瘤微环境(TME)的深入了解,T细胞反应程度的掌握,疫苗与佐剂配方的不断完善以及合适的目标患者的选择等方式,都可以在一定程度上改善现状。
此外,得益于下一代测序、增强的计算能力和先进的算法使鉴定高免疫原性新抗原成为可能,为避免在抗原递呈环节给肿瘤可乘之机,研究者们将个性化肿瘤新抗原的治疗性疫苗的开发逐步落实。Moderna和默沙东今年ASO年会公布的针对切除的高危黑色素瘤(III/IV期)患者的肿瘤新抗原疫苗mRNA-4157(V940)与PD-1(K药)联合治疗结果,在总意向治疗(ITT)人群中,mRNA-4157与Keytruda联合的辅助治疗在次要终点无远处转移生存期(DMFS)上显示出统计学显著和临床有意义的改善,与单独使用Keytruda相比,降低肿瘤产生远处转移或死亡的风险达65%(HR=0.347,95% CI:0.145-0.828;单侧P值=0.0063)。
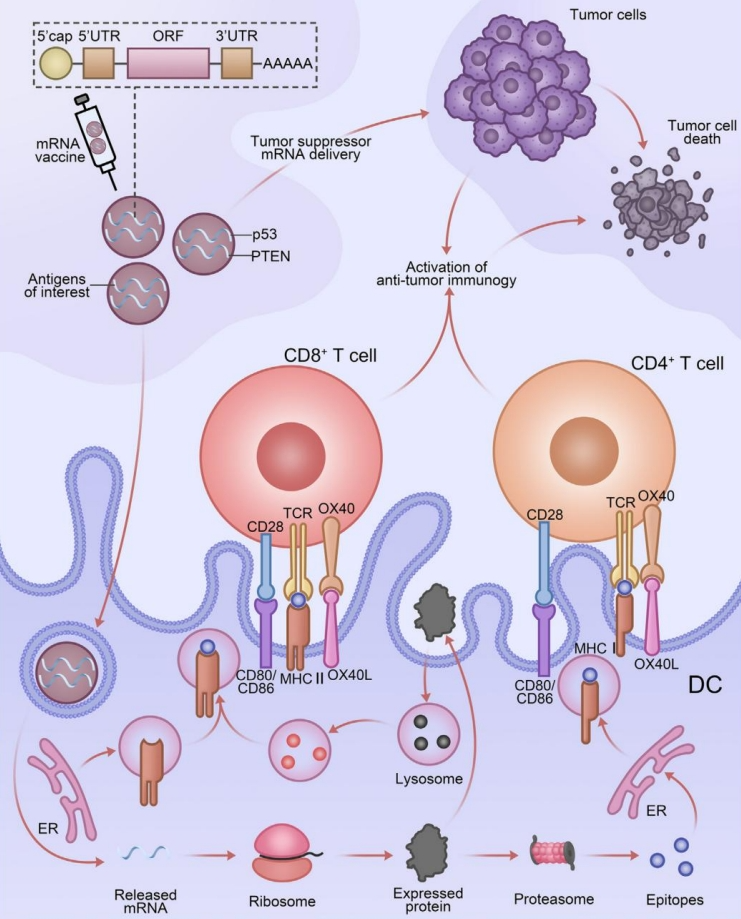
▲mRNA 疫苗的分⼦和细胞机制示例
另外一位mRNA巨头也没闲着,今年5月,Nature刊载了BioNTech、基因泰克及MSKCC的一项肿瘤新抗原疫苗的小规模临床研究:针对极易复发、5年生存率不到10%且几乎无药 可用的胰腺导管癌(PDAC)进行化疗+PD-L1(T药)+肿瘤新抗原疫苗组合治疗,在16例给药患者中,8位患者出现了针对新抗原的T细胞免疫反应,并在整个研究周期内(18个月)都没有出现癌症复发。未出现新抗原免疫反应的患者则大部分都出现了复发,其复发时间的中位数是13.4个月。虽然实验本身没有设置对照组,但从刚好一半对一半的患者表现来看,可以合理推测肿瘤新抗原起到了关键作用。
肿瘤新抗原疫苗与免疫检查点抑制剂的联合疗法突出了mRNA疫苗在癌症防治方面的重大潜力,也打开了mRNA疫苗结合免疫检查点抑制剂和其他治疗方案的探索之门。还是以免疫检查点抑制剂为例,疫苗增强抗原特异性T细胞,而检查点阻断抵消了肿瘤微环境中的免疫抑制,二者可能产生协同作用,从而获得比单一药物更好的效果,加上前文所述的在防止癌症复发方面展现的显著效果,与mRNA疫苗的联合治疗方案有望成为抵消TME的免疫抑制环境,减轻免疫治疗耐药性的优选之策。
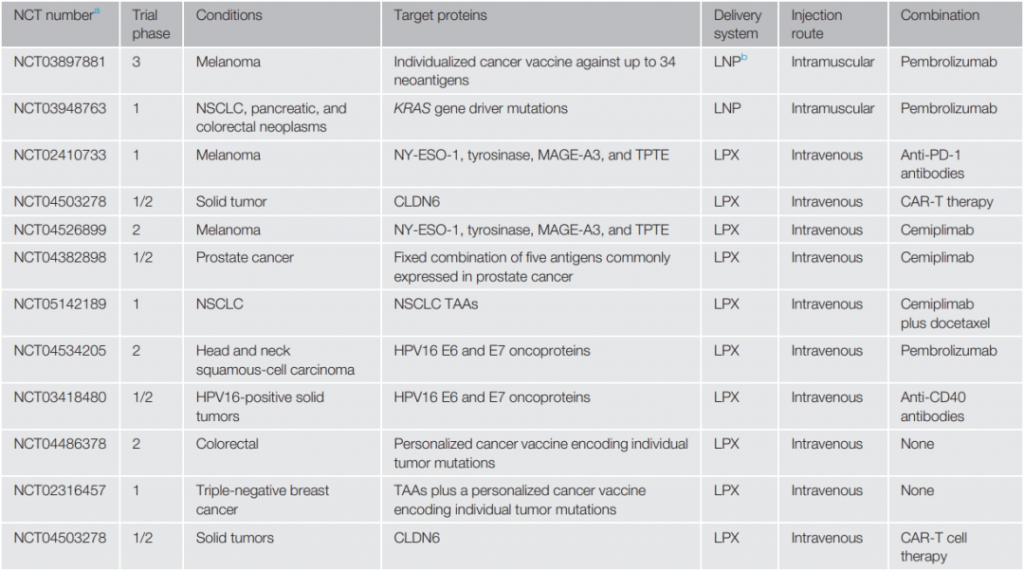
▲mRNA疫苗单药及联合疗法临床试验汇总
值得期待的mRNA肿瘤疫苗进展一览
随着免疫检查点抑制剂和过继细胞疗法等免疫疗法的发展和批准,癌症的治疗方案发生了历史性的变革,作为这次“癌症治疗革命”大潮中的一份子,癌症疫苗在传统的预防性功能基础上,衍生出了专门用于强化患者的免疫系统的治疗性癌症疫苗。同时,得益于精准医疗的前沿进展,个性化癌症疫苗也从设想逐步化为现实,值得期待。
有望攻克“癌症之王”
研发机构:Moderna & 默沙东
项目管线:mRNA-4157(V940),3期
适应症:经手术切除高风险黑色素瘤(IIB-IV期)
mRNA-4157癌症疫苗是根据每位患者肿瘤独特的DNA序列突变特征通过算法设计而成,包含编码最多34种新抗原的单一合成mRNA分子。凭借2期临床(NCT03897881)FDA和EMA分别授予mRNA-4157与Keytruda组合突破性疗法认定和PRIME资格,作为辅助疗法用以治疗完全切除后的高风险黑色素瘤患者。今年7月开启了V940-001关键性3期临床。
“与市面上最好的免疫检查点阻断疗法相比,我们让一半的患者存活下来,这在癌症治疗领域是个巨大的突破。现有的临床证据已经为有条件批准这款mRNA癌症疫苗(mRNA-4157)奠定基础。”Moderna公司首席执行官 Stephane Bancel 在接受采访时表示:“Moderna针对黑色素瘤的mRNA癌症疫苗可能在两年内上市,这将是抗击这种最严重形式的皮肤癌的里程碑式一步。”
有望攻克“癌症之王”
研发机构:BioNTech & 基因泰克(罗氏)
项目管线:autogene cevumeran(RG6180,BNT122),2期
适应症:胰腺导管腺癌(PDAC)
Autogene cevumeran是一款基于BioNTech的iNeST癌症疫苗技术平台生成的个体化新抗原疫苗,可以编码数十种新抗原。今年5月的早期临床结果表明其成功诱导出了靶向胰腺癌癌症新抗原的T细胞活性显示该疗法,显著推迟接受手术切除的胰腺癌患者的复发时间。10月19日,BioNTech宣布已启动Autogene cevumeran的2期临床试验(NCT05968326),用于PDAC患者的辅助治疗。除了PDAC,针对结直肠癌和黑色素瘤的2期临床试验正在进行中。BioNTech联合创始人兼首席医疗官Özlem Türeci博士表示:“最近的1期研究表明,个性化新抗原疫苗接种对于这种具有低突变负荷和免疫抑制微环境肿瘤类型是可行的。自2014年启动的首次临床试验以来,我们一直在评估不同肿瘤的突变,不断探索更多mRNA个性化癌症疫苗的合适靶标。本次2期试验将为我们提供更多数据,帮助Autogene cevumeran在高度未满足的医疗需求环境中更好地为患者提供益处。”
国内首个新抗原DC癌症疫苗
研发机构:立康生命科技
项目管线:LK101,1期
适应症:晚期实体瘤
LK101是一种个性化的新抗原靶向癌症疫苗,也是一种基于树突状细胞 (DC) 的 mRNA 疫苗,采用专利技术结合 mRNA 和 DC 的优势,根据数10种患者特异性肿瘤突变信息将编码个性化肿瘤抗原靶点的 mRNA 转导到树突状细胞中,从而激活针对癌细胞的特异性免疫反应,有望治疗多种晚期实体瘤。据报道,2018年LK101曾在中国人民解放军总医院(301)进行了针对肝癌术后患者的临床试验,初步数据显示,LK101在所有患者中检测到抗肿瘤新抗原免疫反应的激活,并在术后复发率和生存率方面显示出显着优势,安全性良好。
研究人员表示:“后续,LK101的有效性、稳定性将在临床试验中经历严苛考验,同时成本控制、生产工艺等方面也还有很长一段路要走。按照计划,明年将进入临床二期阶段,5到8年后有望实现上市!这意味着,中国的患者有望迎来首款治疗癌症的疫苗!”
破解PD-1耐药难题
研发机构:OSE Immunotherapeutics
项目管线:Tedopi,2期
适应症:非小细胞肺癌(NSCLC),PDAC,复发性卵巢癌Tedopi的设计非常有特点:从5个肿瘤相关抗原中筛选出10个最佳新抗原表位(neo-epitope),再进行组合,刺激T淋巴细胞识别和攻击癌细胞。早期研究证明,Tedopi可激发细胞毒性T细胞对癌细胞的特异性反应和相关的辅助型T细胞反应。目前,Tedopi正在进行2期临床试验,旨在治疗PDAC和复发性卵巢癌患者。
根据今年9月发表在Annals of Oncology杂志上的研究结果,对于那些在连续接受化疗和免疫检查点抑制剂治疗至少12周后仍出现病情进展的HLA-A2阳性晚期或转移性NSCLC患者,Tedopi作为单药疗法与化疗相比,不仅可以提高总生存率,而且具有更好的安全性和生活质量。这些结果为那些已经用尽常规治疗方法、没有太多其他选择的患者带来了希望。
借力AI新机遇
研发机构:Transgene & NEC
项目管线:TG4050,1期(2期临床试验即将启动)
适应症:卵巢癌,HPV阴性头颈癌
TG4050是一款基于MVA病毒载体的治疗性疫苗。NEC公司的AI新抗原预测系统可以识别和选择患者的特异性突变,TG4050可以表达的30多种肿瘤新抗原均由NEC的AI系统选择。目前,该疫苗正在进行治疗卵巢癌和HPV阴性头颈癌的1期临床试验。同时,为了进一步探索TG4050在头颈癌辅助治疗中的潜力,Transgene和NEC公司正筹备开展一项2期临床试验。
今年ASCO年会上展示了TG4050治疗HPV阴性头颈癌患者的1期试验的新数据。数据表明,所有可评估的患者在接受TG4050治疗后都对多种癌症新抗原产生了特异性免疫应答,包含那些在基线时全身免疫状态和肿瘤微环境不利免疫反应产生的患者。同时还报告了两个病例研究:在这些接受TG4050治疗后保持缓解状态的患者中,通过四聚体染色(tetramer staining)评估的结果证实,这些患者的免疫活性T细胞频率大幅增加,进一步证明,TG4050能够诱导抗肿瘤细胞免疫应答。
国产mRNA肿瘤疫苗遍地开花
mRNA技术领跑全球的Moderna、BioNTech,依靠AI生信技术进行肿瘤新抗原筛选也不过在今年初刚刚起步,而国内多家企业不乏像纽安津生物、新合生物等在新生抗原筛选平台及算法上布局多项专利,并有长期数据积累的优秀企业,早已在新抗原的筛选上走得很远。据不完全统计,我国专注mRNA技术开发的至少有26家,并仍在急剧增加,可以说我国mRNA肿瘤疫苗的研发力量并不逊色全球领先水准。
其中,斯微生物自主研发的SWP1001是世界范围内首个获得临床批件的国产自主研发编码新抗原mRNA个性化肿瘤疫苗,也是国内首家进入临床研究公司。
今年6月艾博生物首款mRNA肿瘤药物ABO2011注射液是一款编码人源IL-12mRNA的新型抗肿瘤药物,通过表达IL-12蛋白,激活免疫细胞以发挥抗肿瘤活性。
嘉晨西海的JCXH-211是全球首款表达细胞因子的自复制mRNA癌症治疗药物,标准治疗后进展或对标准治疗不耐受的实体瘤患者(目前仅入组头颈癌和黑色素瘤),目前在中美同步进行临床试验。自复制mRNA癌症疫苗JCXH-212也已进入2期临床试验。
今年1月,启辰生生物治疗原发性脑胶质母细胞瘤的mRNA-DC疫苗—Survivin DC细胞注射液,获得CDE的临床试验批准,成为国内首个获批开展临床试验的mRNA-DC肿瘤治疗性疫苗产品。
威斯津生物鼻咽癌治疗用1类新药EBV-mRNA疫苗于2月启动1期临床。
新合生物自主开发的一款全球首创靶点的靶向胃癌公共新抗原的治疗性mRNA肿瘤疫苗,其肿瘤新抗原预测系统的新抗原预测准确率达75%,即将步入临床阶段。
可以预见,未来mRNA肿瘤疫苗将在触发有效免疫反应的同时,有效防⽌脱靶毒性,并将通过联合用药等形式在抗癌方面发挥更为多样性的功能。