5月全球新药速递
来源:药智网 | 发布时间:2023-05-31
看点
1. NMPA批准首个国产丙肝全基因口服治愈药物
2. 首款国产CD20抗体1类新药获批上市
3. 法布里病治疗迎来新疗法
4. 美国FDA批准首款可重复基因疗法
5. 美国FDA批准首款直接针对泪液蒸发干眼症治疗方法
更多详情请看下文。
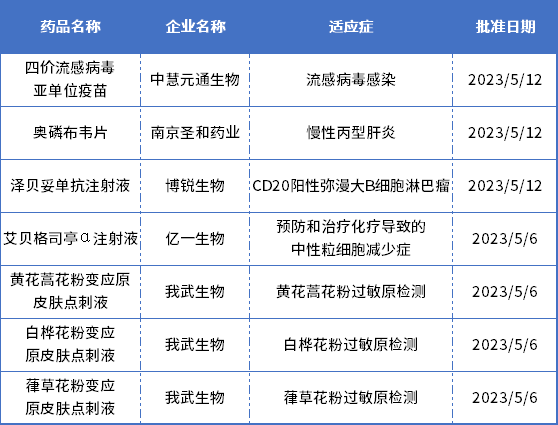
NMPA获批上市的创新药
2023年5月,中国国家药品监督管理局(NMPA)批准了7款1类新药,包括南京圣和药业的丙肝新药奥磷布韦片,博锐生物的CD20单抗泽贝妥单抗注射液,亿一生物的艾贝格司亭α注射液,中慧元通的四价流感疫苗,以及我武生物的3项点刺液品种。
表1. 2023年5月NMPA批准的国产新药
数据来源:NMPA官网、药智数据
奥磷布韦片
奥磷布韦片是圣和药业自主研发的1类创新药,通过优先审评审批程序获批上市。这是首个上市的国产丙肝全基因口服治愈的药物。
奥磷布韦片是HCV NS5B RNA依赖性RNA聚合酶(为病毒复制所必需)抑制剂,是一种核苷酸前体药物,通过肝脏代谢,转化为具有抗病毒活性的非天然核苷三磷酸,与丙肝病毒复制所需的NS5B聚合酶发生竞争性结合,形成错误的病毒RNA模板,使丙肝病毒终止复制。
泽贝妥单抗注射液
泽贝妥单抗是浙江博锐生物自主研发的1类创新型治疗用生物制品,适应症为CD20阳性弥漫大B细胞性淋巴瘤(DLBCL)。这是博锐生物首款1类创新型生物药获批上市,也是首款国产CD20抗体1类新药。目前国内共有7款CD20单抗药物上市,除此之外还有正大天晴、齐鲁制药等20余家药企布局CD20靶点相关药物。
艾贝格司亭α注射液
艾贝格司亭α注射液是亿一生物研发的新一代长效粒细胞集落刺激因子(G-CSF),被NMPA获批用于预防和治疗化疗导致的中性粒细胞减少症。该药作为第三代长效升白药物,是基于Fc融合蛋白技术,由CHO细胞表达的rhG-CSF二聚体,兼具长效和强效的生物学特点,而且具有高稳定性、低免疫原性的显著优势。此前,正大天晴已经与亿一生物签订商业化合作协议,获得亿立舒在中国境内的所有知识产权和独家商业化权益。
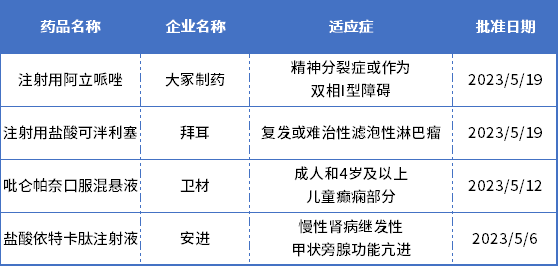
除了国产新药,本月还有4款进口新药首次获得NMPA批准,详情见下表:
表2. 2023年5月NMPA批准的进口新药
数据来源:NMPA官网、药智数据
大冢制药的注射用阿立哌唑,用于治疗成人精神分裂症或作为双相I型障碍患者的单药维持治疗。
拜耳的注射用盐酸可泮利塞(copanlisib),用于治疗既往至少接受过两种系统性治疗的复发或难治性滤泡性淋巴瘤(FL)成人患者。该药是一款静脉注射的PI3K抑制剂,2017年9月获美国FDA加速批准,用于治疗罹患复发性滤泡性淋巴瘤且已经接受了至少两次系统疗法的成人患者。
安进的盐酸依特卡肽注射液,用于治疗慢性肾脏病(CKD)接受血液透析的成人患者的继发性甲状旁腺功能亢进症(SHPT)。该药一种新型钙敏感受体(CaSR)激动剂/拟钙剂,2022年6月,复星医药与安进就盐酸依特卡肽在中国大陆境内的商业化授权达成合作。
卫材的吡仑帕奈口服混悬液,用于成人和4岁及以上儿童癫痫部分性发作(伴有或不伴有继发全面性发作)的治疗。该药是一款选择性、非竞争性的AMPA(α-氨基-3-羟基-5-甲基-4-异恶唑丙酸)受体拮抗剂,它通过靶向抑制突触后膜上AMPA受体的谷氨酸活性,从而降低与癫痫发作相关神经元的过度兴奋。
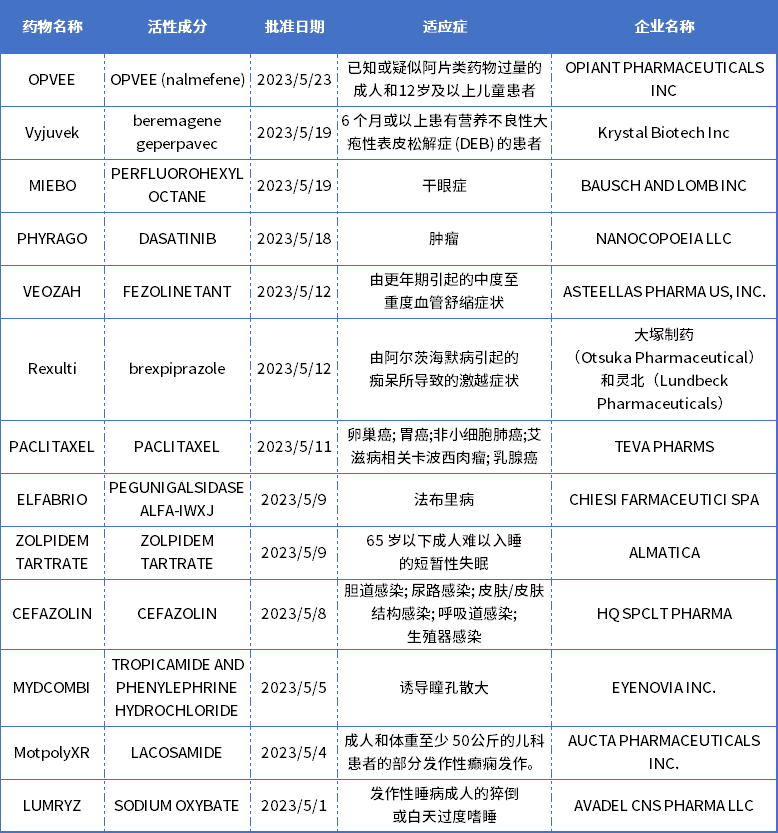
美国FDA批准的新药
美国FDA批准了13款新药,其中药品审评和研究中心(CDER)批准了的2个新分子实体,1款酶替代疗法,生物制品评估和研究中心(CBER)批准了一款可重复基因疗法。
表3. 22023年3月美国FDA批准的新药
数据来源:美国FDA官网
ELFABRIO
ELFABRIO (PRX-102)是Chiesi全球罕见病和Protalix生物治疗公司共同研发的一种新的酶替代疗法,FDA批准用于治疗成人法布里病患者。此前5月6日,欧盟委员会(EC)已授予PRX-102在欧盟治疗法布里病成人患者的上市许可。
法布里病是一种罕见的遗传性酶缺乏症,目前无法治愈,其标准治疗是酶替代疗法,可选择的治疗方法很少。被本次FDA获批的酶替代疗法ELFABRIO是α-半乳糖苷酶的工程版本,是一种水解溶酶体中性鞘糖脂特异性酶。该药每两周输注一次。
Veozah
Veozah(fezolinetant)是安斯泰来(Astellas Pharma)开发的一款口服药物,是第一个被FDA批准用于治疗更年期中度至重度潮热的神经激肽3 (NK3)受体拮抗剂。它通过结合并阻断NK3受体的活动起作用,NK3受体在大脑的体温调节中发挥作用。
MIEBO
MIEBO(PERFLUOROHEXYLOCTANE;以前称为NOV03)由BAUSCH AND LOMB开发,被FDA批准用于治疗干眼(DED),这也是FDA第一个批准直接针对泪液蒸发DED治疗方法。DED是最常见的眼表疾病之一,病因主要是泪液过度蒸发,这主要是由泪液脂质层改变导致,通常与睑板腺功能障碍(MGD)的临床症状有关。不稳定的泪膜会引发眼表干燥、炎症和眼表损伤增加,MIEBO旨在减少眼表泪液蒸发。
Vyjuvek
Vyjuvek(beremagene geperpavec)是Krystal Biotech公司研发的一款使用单纯疱疹病毒(HSV)载体的基因疗法,是一款现货型(off-the-shelf)外用基因疗法,旨在为患者的皮肤细胞提供两个COL7A1基因的正常拷贝,生成功能性VII型胶原蛋白(COL7)蛋白。这也是首个FDA批准的外用基因疗法,也是首款可重复给药的基因疗法,用于治疗营养不良性大疱性表皮松解症(DEB)。VYJUVEK预计将于2023年第三季度在美国上市,欧洲药品监督管理局也已经授权VYJUVEK治疗DEB的孤儿药指定和PRIME(优先药物)资格。