肝细胞癌治疗的临床现状
来源:药时代 | 发布时间:2022-09-06
肝细胞癌(HCC)占原发性肝癌的大多数。在全球范围内,肝癌是癌症相关死亡的第四大原因,在新发病例数量方面排名第六。肝癌的5年生存率仅为18%,是胰腺癌之后排名第二的致死性肿瘤。近年来,肝细胞癌的临床治疗取得了显著的进展。SHARP是第一个为使用多靶点受体酪氨酸激酶抑制剂(RTKI)治疗肝癌奠定基础的临床试验。自SHARP以来,已经有五次成功的3期临床试验。
此外,PD1抑制剂nivolumab和pembrolizumab的第2阶段临床试验展现出良好的前景,并导致FDA的加速批准。最新的3期临床试验显示抗PD-L1抗体Atezolizumab和抗VEGF抗体bevacizumab(atezo/bev)作为一线的联合治疗强于sorafenib,具有优越的无进展生存期(PFS)和总生存期(OS),这是自SHARP以来首次实现这一目标的临床试验。因此,Atezo/bev目前已成为晚期HCC一线治疗的新标准,所有即将进行的临床试验都需要根据这一新基准进行测试。
晚期肝癌一线和二线的全身治疗
有几种治疗方法正试图追随atezo/bev的脚步:cabozantinib联合Atezolizumab(COSMIC-312;NCT03755791);lenvatinib联合pembrolizumab,(LEAP-002;NCT03713593);durvalumab联合抗CTLA-4抗体tremelimumab(HIMALAYA;NCT03298451);nivolumab联合ipilimumab(CheckMate 9DW;NCT04039607);抗PD-1抗体camrelizumab(SHR-1210)联合apatinib(NCT03764293)以及抗PD-1抗体tislelizumab的单一疗法(RATIONALE-301;NCT03412773)。
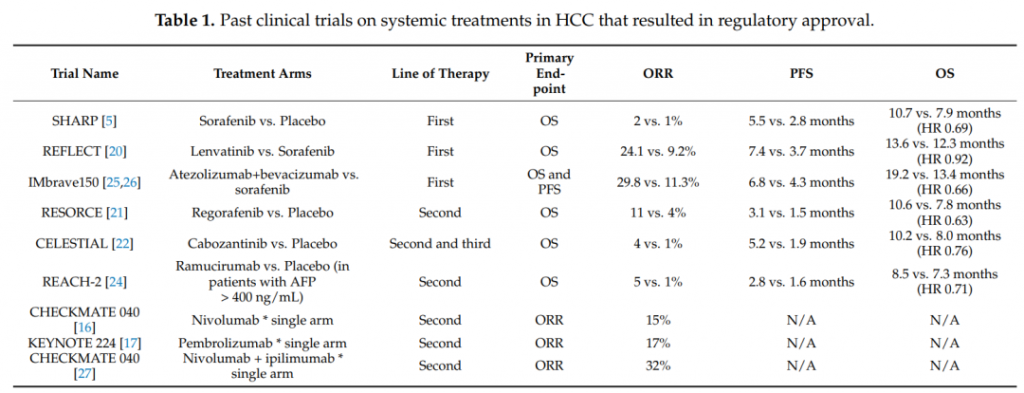
这些组合目前正在进行第3阶段临床试验,采用同样的类似设计:所有试验均为一线治疗,包括不能切除的HCC患者,即中期患者(BCLC B),以及晚期患者(BCLC C)。这里唯一的例外是CheckMate 9DW,它仅限于晚期HCC。至于主要终点, COSMIC-312、LEAP-002和camrelizumab+apatinib试验根据RECIST 1.1使用PFS和OS,而HIMALAYA、CheckMate 9DW和Rational-301仅使用OS。值得一提的是,目前这些3期临床试验均未使用Atezo/bev作为对照,而是sorafenib或lenvatinib。此外,还有一些联合治疗处于临床的早期阶段(1期或2期),值得注意的是,所有试验都包括一种检查点抑制剂。两项试验正在评估regorafenib和nivolumab的组合(NCT04170556和NCT04310709)。regorafenib也正在与pembrolizumab(NCT03347292)和tislelizumab(NCT04183088)进行联合治疗的临床试验,还有cabozantinib与pembrolizumab(NCT04442581)以及sitravatinib与tislelizumab(NCT03941873)。
中期肝癌的全身治疗
IMbrave 150试验纳入了不能切除的HCC患者,即BCLC B和C期,其中>80%的患者为BCLC C期。由于BCLC B期患者的比例相当小(~15%),目前无法对该类型患者组的atezo/bev疗效进行最终评估,尤其是与经导管肝动脉化疗栓塞(TACE)治疗(目前的护理标准)的比较。ABC-HCC(NCT04803994)是一项研究者发起的比较atezo/bev和TACE的大型3b期临床试验,它将准确地回答这个问题。此外,RENOTACE(NCT04777851)是另一个由大型研究者发起的3期临床试验,该试验将测试regorafenib联合nivolumab对比TACE的效果。这两种临床试验将为BCLC B期患者的全身治疗铺平道路。然而,设计此类临床试验的挑战在于它们比较的是两种不同的治疗方式。因此,ABC-HCC试验采用了一种新的主要终点,即测量研究者因治疗失败而停止治疗(atezo/bev或TACE)的时间。相比之下,RENOTACE在这方面更为保守,使用了PFS。在未来的几年中,其他针对中期肝癌与TACE比较的临床试验肯定会跟进。治疗中期肝癌的另一种可能是在TACE中增加全身治疗。目前有三个3期试验正在进行中。LEAP-012正在测试在TACE中添加lenvatinib和pembrolizumab(NCT04246177),EMERALD-1试验在TACE中添加durvalumab或durvalumab加bevacizumab(NCT03778957),以及CheckMate 74W试验在TACE中添加nivolumab或nivolumab加ipilimumab(NCT04340193),所有这些试验均与TACE单独进行比较。
辅助治疗
到目前为止,在治疗性肝切除术或消融术后的辅助治疗中,还没有一种全身治疗被证明是有益的。STORM试验未能证明sorafenib在这方面的益处。
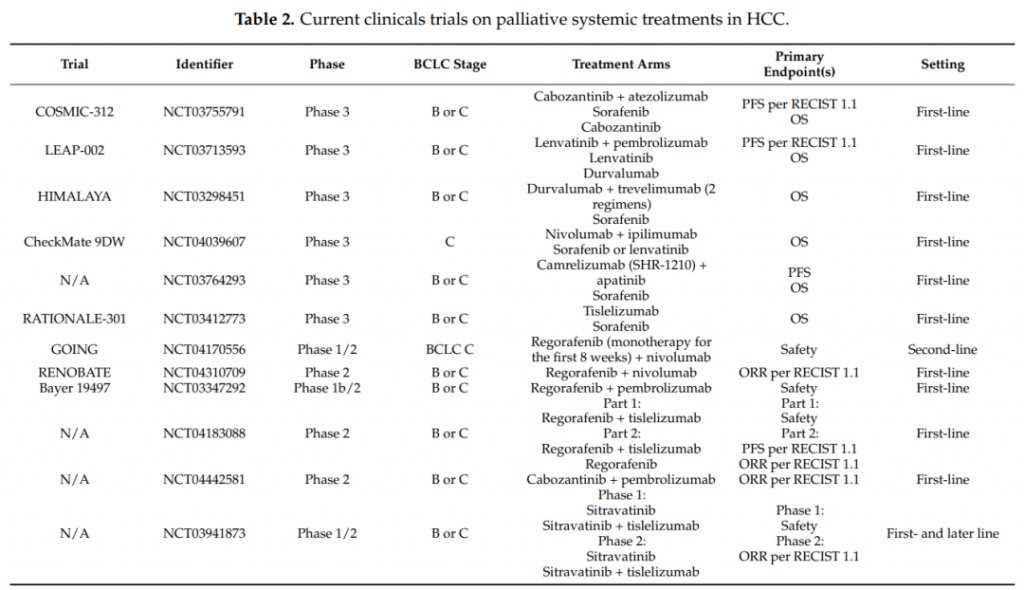
目前正在进行的四项3期试验正在探索新的方法:CheckMate 9DX试验正在测试使用nivolumab的辅助治疗(NCT03383458);KEYNOTE-937试验测试使用pembrolizumab的辅助治疗(NCT03867084),IMbrave050试验测试atezolizumab和贝伐单抗辅助治疗(NCT04102098),以及EMERALD-2试验测试durvalumab加或不加贝伐单抗的辅助治疗(NCT03847428)。
新辅助治疗
目前没有成熟的数据支持在手术或局部治疗前使用全身性药物。然而,评估新辅助治疗的早期临床试验正在进行中。NIVOLEP试验正在评估电穿孔消融前后nivolumab治疗的疗效(NCT03630640);CaboNivo试验正在评估局部晚期/临界可切除HCC肝切除术前联合cabozantinib和nivolumab的安全性(NCT03299946)。
还有即将开展的测试pembrolizumab在治疗性消融或切除前后的疗效(NCT03337841);PLENTY202001试验正在测试肝移植前lenvatinib和pembrolizumab联合治疗的疗效(NCT04425226)。总之,新辅助治疗是全身治疗的一个未知领域,这些新概念中的哪一个将最终实现还有待观察。
细胞治疗和基因治疗
HCC的细胞和基因治的大多数仍处于临床前或临床早期阶段。此类免疫疗法包括嵌合抗原受体(CAR)-T细胞、异基因NK细胞和溶瘤病毒。

目前,有六项已登记的针对Glypican 3(GPC3)的CAR-T细胞的1期临床研究(NCT04121273;NCT04506983;NCT03198546;NCT02905188;NCT03884751;NCT03980288)。有一项2期研究比较了iNKT细胞治疗加TACE与单纯TACE治疗比较的效果(NCT04011033)。类似地,FT500(一种异基因NK细胞系)和FATE-NK100(一种供体来源的NK细胞)正在包括HCC在内的各种癌症适应症中进行1期试验(NCT03319459;NCT04106167;NCT03841110)。在TRAVERSE 2b期试验中,溶瘤病毒pexastimogene devacirepvec(Pexa Vec)作为二线单药治疗晚期肝癌失败后,目前正在与nivolumab联合进行1/2a期试验(NCT03071094)。然而,PHOCUS的3期试验(NCT02562755)研究了PexaVec和sorafenib的组合,由于在中期分析中明显缺乏临床益处,被提前终止。这也突出提示了新免疫治疗方法在HCC治疗中的风险。
小结
近年来,肝癌的全身治疗取得了相当大的进展,未来几年将看到大量来自3期临床试验的数据,这些数据很有可能给HCC的临床治疗带来深刻的变化。
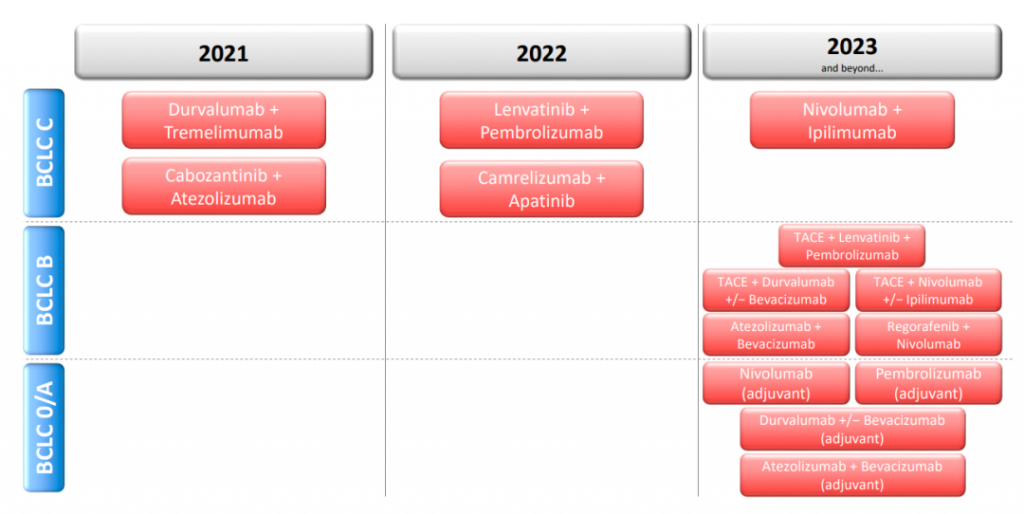
到目前为止,atezo/bev是第一种也是唯一一种对肝癌有疗效的免疫疗法。而且此类药物不再局限于晚期HCC,而是囊括了疾病的早期阶段。此外,其它的免疫治疗方法,如CAR-T或CAR-NK细胞,现已进入临床开发阶段,并可能进一步扩大对HCC的治疗范围。总之,目前HCC的肿瘤免疫治疗的前景非常看好。肿瘤免疫疗法现在在肝癌的治疗中占有一席之地,而且它的覆盖范围可能会继续扩大。在未来几年,临床试验将提供大量令人振奋的数据,有望为肝癌患者提供更好的治疗选择和预后改善。参考文献:1. The Current Landscape of Clinical Trials forSystemic Treatment of HCC. Cancers (Basel). 2021 Apr; 13(8): 1962.