一文了解生物药生产关键生产设施设备变更管理相关政策
来源:佰傲谷BioValley | 发布时间:2022-09-06
中国的生物制药产业蓬勃发展,在商业化生产,特别是扩大产能的过程中,生物药生产关键生产设施设备变化是生产常态,也是客观必然,国家药监局2021年1月13日颁布实施的《药品上市后变更管理办法(试行)》,作为我国首部针对药品上市后变更的系统性规范性文件,明确对药品生产许可证持证企业药品生产变更实施分类管理,有效衔接生产管理变更和注册管理变更,简化药品生产关键生产设施设备变更管理等利好行业政策,充分考虑我国当前医药产业发展实际状况,基本涵盖了药品药学和临床相关变更流程不明确的问题,但未全部涵盖药品生产关键生产设施设备变化管理实施细则,那么生产关键生产设施设备变化操作流程是如何操作的?笔者整理了江西省药品监督管理局新发布的《药品生产许可关键生产设施变化管理暂行规定(征求意见稿)》,本文示例不能涵盖所有生产关键生产设施设备变化情形,仅供参考。
一、药品生产关键生产设施设备变化法规政策依据
(1) 2019年12月1日开始实施的《药品管理法》明确要求按照其对药品安全性、有效性和质量可控性的风险和产生影响的程度,对药品生产过程中的变更实行分类管理。属于重大变更的,应当经国务院药品监督管理部门批准,其他变更应当按照国务院药品监督管理部门的规定备案或者报告。药品生产关键生产设施设备变化理论上属于其他变更类。
(2) 2020年7月1日开始实施的《药品注册管理办法》按照风险管理的原则落实“放管服”要求,对变更实行分类管理,没有明确提到药品生产关键生产设施设备变化如何管理。
(3) 2020年7月1日开始实施的《药品生产监督管理办法》按照风险管理的原则落实“放管服”要求,对变更实行分类管理,明确了工艺变更管理和控制(第四十三条)和关键人员变更登记(第十五条、第四十五条),没有明确提到药品生产关键生产设施设备变化如何管理。
(4) 2021年1月13日颁布实施的《药品上市后变更管理办法(试行)》,明确对药品生产许可证持证企业药品生产变更实施分类管理,有效衔接生产管理变更和注册管理变更,与药品注册事项变更内容相比药品生产监管变更事项似乎内容较少,同步发布的附件《药品上市后变更管理办法(试行)》政策解读回答了是如何考虑的?即药品上市后变更包括药品注册事项变更和药品生产监管事项变更,《办法》规定的变更管理原则适用于药品全生命周期管理中的变更,具体内容主要明确了药品注册变更事项,涉及的药品生产监管事项变更仅规定了与注册变更事项密切相关的药品生产场地变更,对于其他如空调系统、水系统等变更按照《药品生产监督管理办法》《药品生产质量管理规范》等相关规定实施,《办法》中不再赘述。
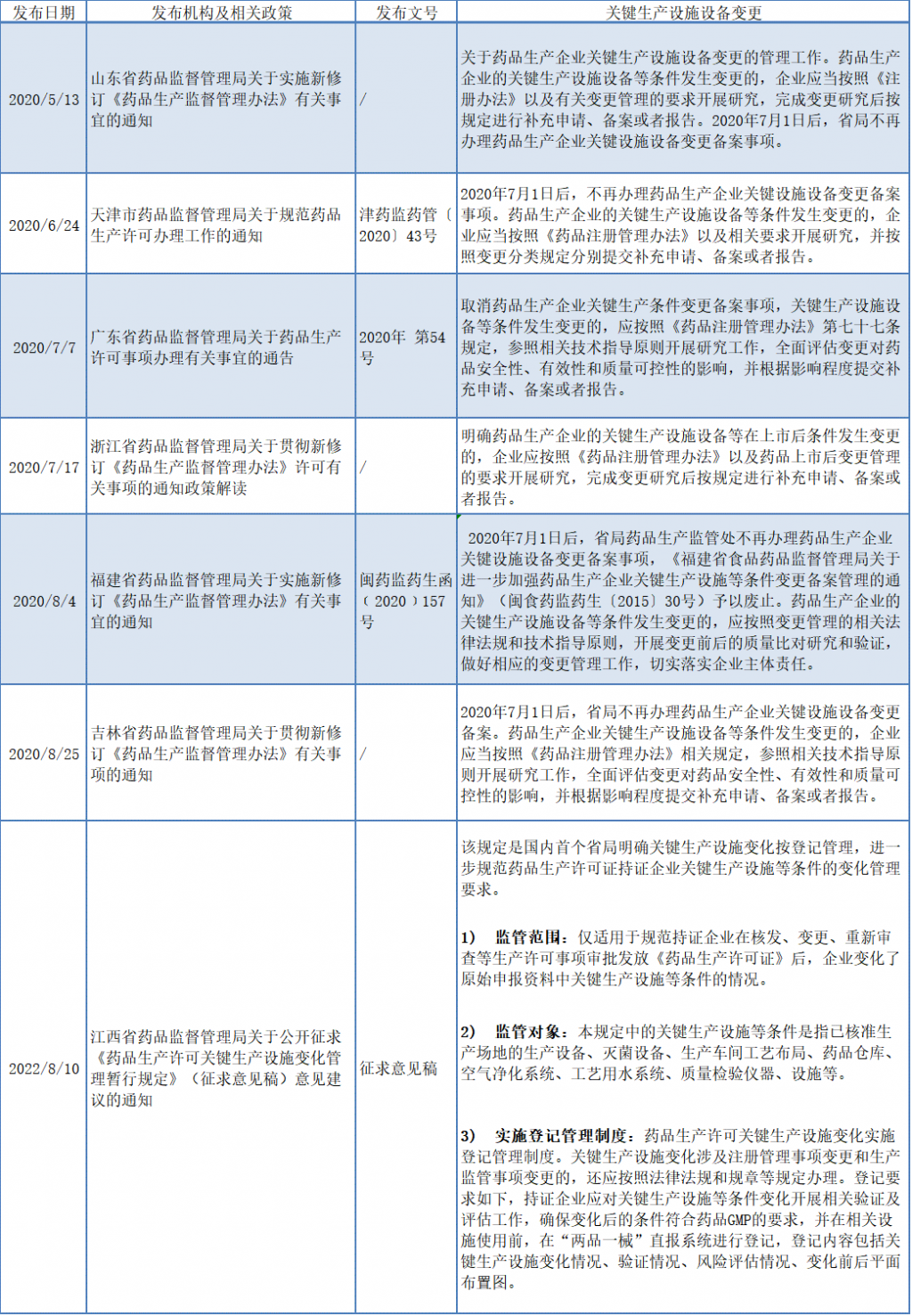
二、省局对药品生产关键生产设施设备变化相关政策
自2020年7月1日开始实施的《药品生产监督管理办法》后,有些省份已经取消了药品生产设施设备变更备案,即省局不再办理药品生产企业的药品生产关键设施设备变更备案事项,笔者查阅了相关省局网站,已发布的省局相关通知,大部分明确药品生产企业的关键生产设施设备等条件发生变更的,企业应当按照《药品注册管理办法》以及相关要求开展研究,并按照变更分类规定分别提交补充申请、备案或者报告,关键生产设施变化涉及注册管理事项变更和生产监管事项变更的,还应按照法律法规和规章等规定办理,但有些关键生产设施变化一般不涉及注册管理事项变更和生产监管事项变更的,在现有上市后变更相关法律法规和规章等规定找不到办理的依据,江西省药品监督管理局新发布的《药品生产许可关键生产设施变化管理暂行规定(征求意见稿)》给药企变更管理人员提供了一个相关参考依据,如不涉及注册管理事项变更和生产监管事项变更的关键生产设施变化,药品生产许可关键生产设施变化实施登记管理制度。相关政策梳理如下表: