中国罕见病临床研究现状的分析与思考
来源:凡默谷 | 发布时间:2025-03-25
摘要:罕见病多为遗传性疾病且常在儿童期发病,具有病情严重、诊治困难、诊疗同质性差等特点。罕见病临床研究有助于提高我国罕见病诊疗能力,推动罕见病医学发展。我国对罕见病的临床研究起步较晚,目前暂无成熟完善的罕见病临床研究体系。该文通过分析我国罕见病临床研究的现状,梳理目前存在的问题及研究难点,提出我国罕见病临床研究体系的建设思路和关键举措,旨在为我国罕见病临床研究体系建设提供意见及建议。
罕见病是指一类发病率或患病率很低的疾病,多为遗传性疾病且常在儿童期发病,具有病情严重、诊治困难、医疗耗费高昂、诊疗同质性差等特。由于不同国家经济水平、疾病流行病学特征不同,全球范围内尚未就罕见病的定义达成共识。据估计,全世界有近万种罕见病,中国有超2000万罕见病患者。《中国罕见病定义研究报告》(2021)中将符合“新生儿发病率小于1/10000、患病率小于1/10000或患病人数小于14万”的疾病定义为罕见病。近年来,国家高度重视罕见病的诊疗研究。2024年政府工作报告指出要加强罕见病研究、诊疗与保障。《中国罕见病药物可及性报告》(2019)指出:我国罕见病患者面临诊断难、诊断后无药可医、国外治疗药物未在我国上市和已上市药品价格昂贵等困境。临床研究是连接基础研究与临床诊疗,实现医学研究成果转化和临床应用的关键环节。因此罕见病临床研究将有助于更好地理解罕见病的流行病学、临床表现、疾病机制等,有利于提高罕见病诊疗能力,还有利于促进罕见病新药和新疗法的开发,推动罕见病医学的发展。本文旨在通过分析我国罕见病临床研究的现状,梳理目前存在的问题及研究难点,提出我国罕见病临床研究体系的建设思路和关键举措,为我国罕见病临床研究体系建设提供意见及建议。
1.我国罕见病临床研究相关政策
为促进罕见病临床研究,国家药品监督管理局等部门发布了多项政策。2019年—2024年5年间,我国颁布了24项鼓励罕见病临床研究的相关政策,包括宏观的指引性纲领、上市前临床试验策略的优化、罕见疾病药物临床研究指导原则等(部分重要政策文件名称见表1)。可见,国家对于罕见病临床研究的关注达到了一个新的高度。
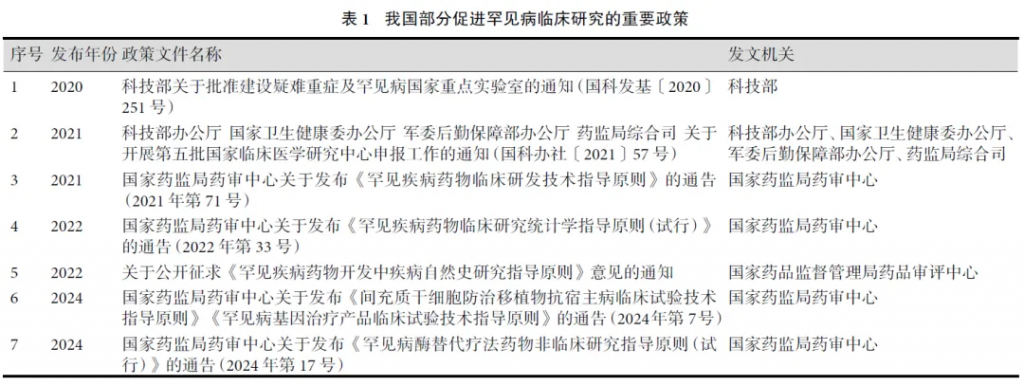
2.我国罕见病临床研究现状及存在问题
目前,我国针对罕见病的政策研究、救治保障等方面的讨论比较热烈,但罕见病临床研究方面的讨论却相对较少。这可能与罕见病临床研究目前面临的挑战有关。一方面,罕见病单病种患病人数少、居住分散、不易招募受试者;另一方面,有能力从事罕见病临床研究的研究者也非常有限。一项调查报告显示,33%的医生承认自己不太了解罕见病,甚至有1%的医生从未听说过罕见病。在中国临床试验注册中心(Chinese Clinical Trial Registry)平台,2014年—2023年10年间有440项针对发病率相对较高的罕见病的临床试验注册,现对其注册日期、研究阶段、研究规模、研究类型及地域分布等情况进行分析,进而剖析其中存在的问题。
2.1 罕见病临床研究整体受政策牵引影响
从注册日期来看,罕见病临床试验数量呈现逐渐增多的趋势,在2021年达到高峰,仅1年内就有106项临床试验注册。具体趋势分布如图1。
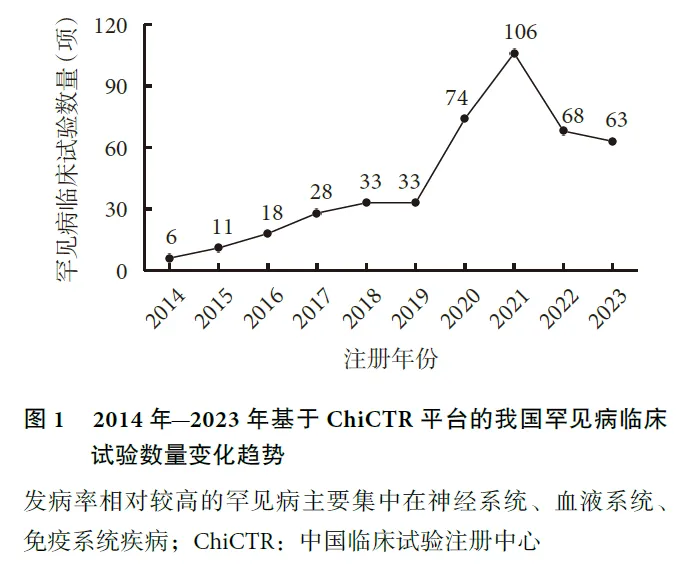
2018年及2023年,我国发布了2批《罕见病目录》,共纳入207种罕见病。目录的发布在中国罕见病医学史上具有里程碑式的意义,在此期间我国罕见病事业蓬勃发展,密集出台了一系列罕见病利好政策。政策密集发布时间与罕见病临床试验注册数量增加时间基本吻合,说明国家政策的导向对罕见病临床研究的开展起到了正向推动作用。
2.2 罕见病临床研究自主创新能力有待提升
从临床研究阶段来看,Ⅳ期临床试验(56/440,12.7%)较Ⅰ期和Ⅱ期临床试验(25/440,5.7%)多,这可能的原因是我国罕见病临床研究起步较晚,大多数药物依赖进口。罕见病药物在国外通过早期的安全性和有效性测试后,国内引进该药物通常开展大规模验证和上市后监测。此外,表示该临床研究无法简单地归类到标准临床研究阶段的“其他”占比较大(159/440,36.1%),侧面说明了罕见病临床研究的复杂性及特殊性。见表2。
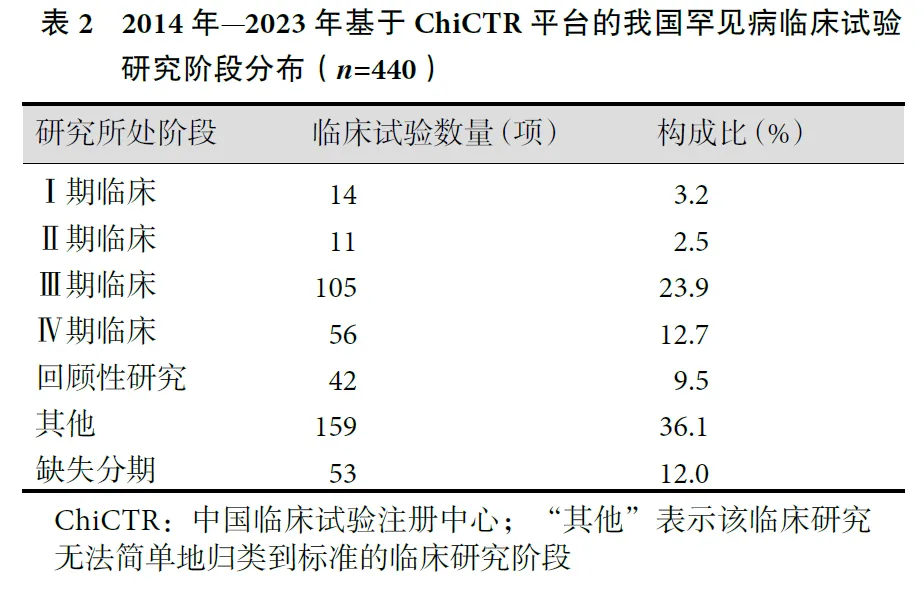
目前国内已上市的罕见病药物仍然以跨国药企引进、国内药企合作引进和药物仿制等为主。2018年—2023年我国批准上市用于治疗第一批罕见病目录中的治疗药物只有2个为Ⅰ类创新药,且均为国际制药公司以国际多中心临床试验设计申请获批。我国缺乏从“0”到“1”的原研药,故罕见病临床研究自主创新能力有待提升。
2.3 高质量罕见病临床研究缺乏
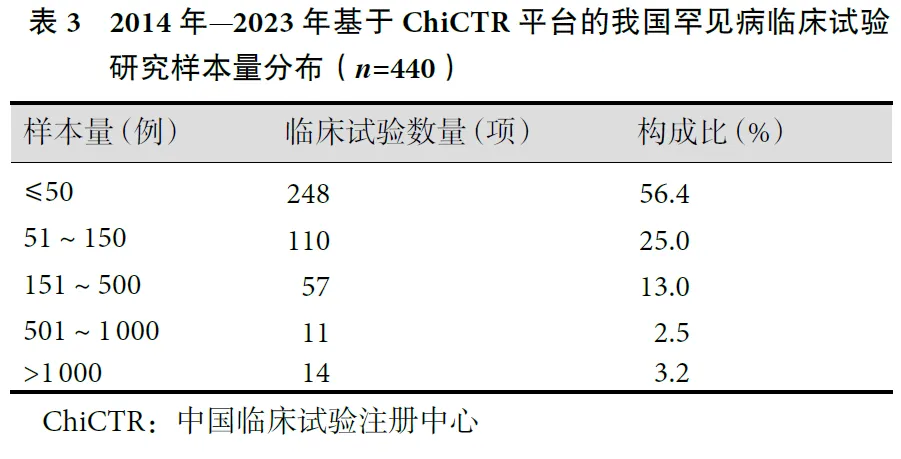
从受试者规模来看,罕见病临床研究样本量较小,主要集中在500例以内,超过500例的临床试验数量仅有25项,具体数量分布情况见表3。高质量的临床研究一般基于大样本量,因为大样本量有助于提高临床研究的统计效力。但罕见病发病率低,单病种患病人数少,罕见病临床研究难以招募到大量受试者。
从临床试验类型来看,干预性研究(205/440,46.6%)最多,其次为观察性研究(172/440,39.1%),具体分布见表4。从临床试验设计方案来看,罕见病临床研究中平行对照试验设计最多,其次是单臂开放试验。虽然随机对照试验常被作为评价药物安全性和有效性的金标准,并被大多数疾病的临床研究采用,但由于罕见病疾病异质性大,疾病的诊断和评估往往缺乏标准化的方法,这使得研究人员难以确定合适的对照组和疗效评估的标准。因此,在不损失科学性的基础上,探索符合罕见病临床研究特点的试验设计方法,比如采用适应性设计、篮式设计、平台试验设计等是十分有必要的。

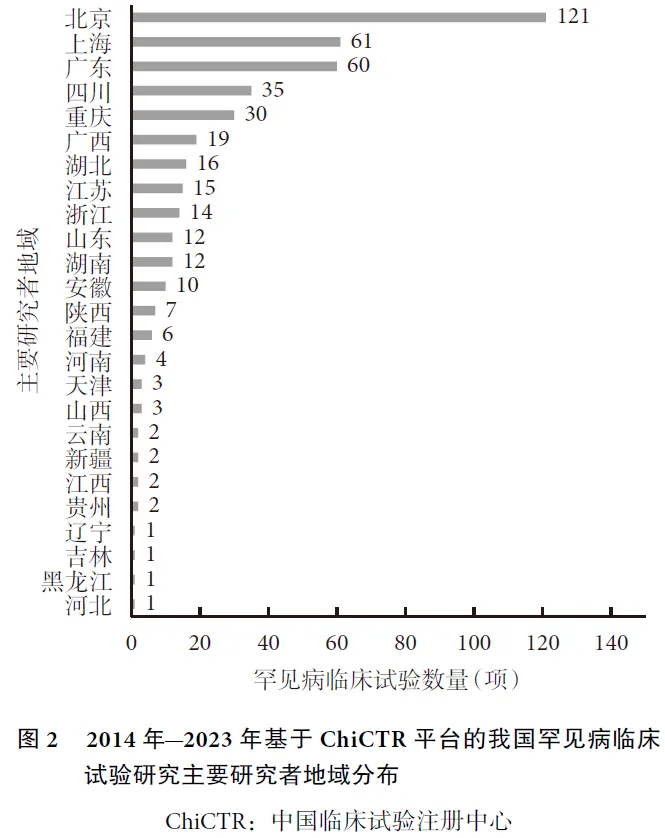
2.4 罕见病临床研究者地域差异较大
从罕见病临床研究立项地域分布情况来看,全国25个省/直辖市/自治区开展了罕见病临床研究,但各地差异较大。经济发达地区比如北京、上海、广东等地开展临床试验相对较多,西藏、宁夏、内蒙古、海南、甘肃及青海等经济欠发达地区尚无开展,具体分布如图2。这可能的原因是经济发达地区拥有较多的大型医院、高校和科研机构,并能为罕见病临床研究提供更多的资金支持和资源配置;而经济欠发达地区由于资金及资源受限,故临床研究的重点通常集中在常见病和多发病,而非罕见病。
3.我国罕见病临床研究体系的建设思路
3.1 紧跟政策指引,重视罕见病临床研究
近年来,国家各部委高度重视及支持罕见病临床研究。国家卫生健康委员会实施“重大新药创新”科技重大专项支持相关罕见病药物研发。国家自然科学基金委员会生命与医学板块设立“罕见肿瘤研究”专项,并在2024年发布指南引导类原创探索计划项目——罕见病诊疗新策略及新机制,旨在促进我国罕见病原创性研究。国家科学技术部依托“十三五”国家重点研发计划开展“中国罕见疾病防治研究与示范”项目,建立罕见疾病临床资源数据库和罕见病临床队列,进行中国人群重要罕见病的精准诊疗技术与临床规范研究等课题。开展罕见病临床研究的医院、高校及科研机构需紧跟国家政策指引,加强我国自主原创药物从“0”到“1”的研究,在全国范围内营造良好的研究环境来推进罕见病临床研究高质量发展。
3.2 建设优质共享数据库,加强高质量罕见病临床研究
罕见病临床研究的基础在于临床数据收集整合。我国通过建立国家医院质量监测系统、国家罕见病注册系统及罕见病诊疗直报系统,形成了我国的罕见病生物样本库及临床数据库,一定程度上实现了罕见病数据的整合。但罕见病临床研究的数据共享仍是需要探索的问题,包括数据库里哪些数据能共享,哪些人员能共享数据,用哪种方式进行共享,以及如何保障数据的隐私和安全等。
在共享数据的管理方面,可考虑设立罕见病临床研究数据共享管理委员会。该委员会可由医学专家、法律专家、伦理专家、科研人员代表及数据处理人员等构成,负责数据方案申请、使用数据提取、使用跟进等,并对数据使用的安全和可行性进行全方位保障。
在共享数据的使用方面,可按照不同的罕见病专病,设立数据的分类分级管理。例如根据不同项目组参与情况,项目组人员优先享有数据使用申请权;非项目组申请人需有相应研究领域的丰富经验和专业知识,且有相应级别的课题支撑。针对共享数据的类型不同,原始数据不进行共享,而是将某个课题组的研究数据进行共享。至于数据分享是对原有数据的直接复制、上传,还是通过接口方式实时同步,可以根据具体的业务需求和场景选择最合适的方法。
在共享数据安全保障方面,数据使用获批后需签署相关数据使用协议书,约定双方权责、申请者对数据的保护措施或策略、不慎泄露的应急方案、数据使用期限等。
在共享数据的资金资助方面,我国目前资金来源有各级政府及院校的科研项目等,除此之外也可以通过向数据申请者收取一定的费用来覆盖数据收集、处理及管理的成本。纵观国外的共享数据库,其运行主要依靠医药企业支持的商业模式。而在我国,共享数据库推行商业化融资还不成熟,数据库与医药企业的商业化合作模式尚有待进一步探讨。
在共享数据的伦理考量方面,罕见病数据的共享要在保证患者隐私不泄露的情况下,实现罕见病数据采集。可参考美国在《健康保险流通与责任法案》中的方案,即在不共享原始数据的情况下进行多中心联合分析建模,不保存数据,只共享模型的实时副本。
3.3 推动远程化临床研究,助力经济欠发达地区罕见病临床研究
经济欠发达地区因其地理、交通、人口稀少等因素,医疗资源相对匮乏,临床研究硬件及软件条件均不足,制约了其开展罕见病临床研究。在这些地区推行远程化临床研究模式是十分有必要的。首先是受试者远程招募,可利用互联网媒体等为患者提供临床研究相关信息,并采用大数据分析技术构建智能算法,以便受试者智能筛选。其次是在试验药物管理及返回方面,可采用临床药物直达与远程药物回收技术,提高药物使用的便捷度,进而增加受试者参与度。最后是远程访视与评估,可利用可穿戴医疗设备,实时收集数据,并通过网络直接传输给临床研究者,形成完整的受试者数据链,从而为受试者提供了一个高效且低成本的随访方案。
3.4 利用人工智能及大数据分析技术,加快罕见病临床研究发展
21世纪以来,人工智能及大数据分析技术与医学的广泛交叉融合快速推动罕见病临床研究的发展,为解决临床问题提供了新的思路和方法。人工智能可以有效地将大量生物医学知识和数据融合,通过快速处理各种来源的广泛数据集而迅速识别诊断罕见疾病。大数据分析技术可以利用基于疾病模型的研发思路,通过在罕见病临床诊疗中获得的数据,经过数学和统计模型模拟临床试验结果,为制定罕见病临床诊疗决策提供信息和依据,加快罕见病的研究进程。
基于上述人工智能及大数据分析技术,国内外学者开发了一系列罕见病临床决策支持系统(clinical decision support system, CDSS)以辅助医生决策。CDSS工具分别从整合现有知识库、文献挖掘、临床电子病历挖掘、在线相似病例检索以及机器学习方法等方面进行研究。因此,基于罕见病CDSS,将大量罕见病权威诊疗经验形成可落地的工具嵌入到临床工作中,可以帮助经济欠发达地区及基层医师提高罕见病识别能力,减少基层医疗机构的误诊、漏诊,为临床研究纳入合适的目标受试者提供支撑。
4.结语
深入开展罕见病临床研究,是面向国家医学科技进步重大需求,也是推动和引领医学科技创新的重要举措,还是增进罕见病患者健康福祉、落实健康中国战略的必然要求。国家已在罕见病临床研究领域作出了重要部署,研究机构应积极响应国家政策,加强罕见病自主创新研究。随着罕见病临床研究工作的深入,我们应继续建立完善优质的共享罕见病数据库,持续完善我国罕见病生物样本库及临床数据库,推行远程化临床研究模式,利用人工智能及大数据分析等技术推动罕见病临床研究深度发展。