2024年度100个新靶点
来源:医药魔方 | 发布时间:2025-02-28
摘要:2024年,科学家们在多个疾病领域发现了众多新靶点,特别是在癌症、肥胖、神经退行性疾病等领域取得了显著进展。癌症免疫治疗方面,发现了如SMARCAL1、GSDMD、Osr2等靶点,其中GSDMD激动剂被证明能刺激抗肿瘤免疫力而不引起毒性;肥胖领域中NK2R和PTER靶点的发现为减肥药物提供了新的方向,特别是NK2R激动剂既能降低食欲又能促进热量消耗;神经退行性疾病领域IDO1靶点的抑制有助于改善阿尔茨海默病的认知功能;此外,在CAR-T细胞疗法中FOXO1和Transgelin 2的发现增强了T细胞的抗癌活性。这些里程碑式的发现不仅拓宽了我们对疾病机制的理解,也为开发新型治疗方法开辟了道路。中国科学家在这一进程中亦表现突出,贡献了多项重要研究成果。
新靶点发现是推动创新药研发突破的关键。一个里程碑靶点的发现将大大加速突破性疗法的诞生,改变疾病的治疗格局。历史上,TNF-α、PD-1、GLP-1R、IL-4Rα、IL-12p40等靶点更是缔造出了年销售额超百亿美元的超级重磅炸弹药物。2021、2022及2023年,医药魔方Pro连续推出了《100个新靶点》年度盘点特别企划文章,受到了读者的广泛关注。刚刚过去的2024年,新靶点依旧不断涌现。
在癌症领域,科学家们发现了超45个新靶点,包括癌症免疫治疗靶点SMARCAL1, SOX17, PGE2, CD3L1, IGSF8, Osr2, GSDMD, IRGQ, SLC6A6等,以及提升CAR-T及CAR-NK细胞疗法疗效的靶点FOXO1, Transgelin 2, MCJ, CALHM2, Cullin-5等。
在肥胖领域,2024年,科学家们发现的新靶点包括PSD95, PICK1, NMDA receptor, LGR4, PXR, PTER, RUVBL2, NK2R, ABHD6等。
在神经退行性疾病领域,HTRA1, LILRB4, NMNAT2, IDO1等新靶点值得关注。与NASH/MASH相关的新靶点包括SIKE, MS4A7, Atf3, Rbp4等。此外,科学家还发现IL-11, p21等衰老相关靶点。
除此之外,过去一年,自身免疫性疾病、糖尿病、纤维化疾病、ALS、炎症性肠病、多囊卵巢综合征、镰状细胞病、炎症疾病、多发性硬化症、神经性疼痛、SARS CoV-2 感染、糖尿病血管病变、HBV感染、心力衰竭、骨质疏松症等疾病领域在新靶点发现方面也有进展。
值得一提的是,2024年中国科学家在新靶点发现方面取得了丰硕成果,多个团队在Cell、Nature、Science等期刊上发表相关论文,发现了多个抗癌靶点,如SLC6A6, CD3L1, IGSF8, Osr2, ACSL4, ECH1, 7-DHC, DHCR7, FGA等;此外,在类风湿性关节炎(NAT10)、HSV感染(TMEFF1)、肥胖(LGR4, PXR等)、糖尿病(Nogo-B, DRAK2等)、多囊卵巢综合征(LONP1-CYP11A1)、脓毒症(BMP9)等领域均发现了新靶点,展现了源头创新的实力。
本文梳理并筛选出了2024年值得关注的100个新靶点(详见文末表格),希望能够给国内创新药研发人员和投资者提供一些参考。在这100个新靶点中,有近30个入选医药魔方NextPharma转化医学里程碑成果,以下选择其中的15个里程碑靶点做详细介绍:
里程碑靶点①:NK2R
杂志:Nature
领域:肥胖
论文:DOI: 10.1038/s41586-024-08207-0
成果:2024年11月13日,来自丹麦哥本哈根大学的科学家在Nature杂志发表了一项突破性成果。他们发现了一种新的减肥药物靶点——NK2R。他们开发的first-in-class选择性长效NK2R激动剂,不仅能有效降低食欲,而且不会导致肌肉质量减少,也不会引起恶心、呕吐等不良反应。更重要的是,与现有治疗方法相比,这款药物还能促进身体热量的消耗。K2R激动剂在非人灵长类动物中针对糖尿病和肥胖的治疗效果显著,为那些对现行治疗方案反应不佳的患者带来了新的希望。(推荐阅读:Nature突破:一箭双雕!减肥新靶点NK2R来了,既能降低食欲,又能燃烧热量)
里程碑靶点②:GSDMD
杂志:Cell
领域:癌症(免疫疗法)
论文:DOI: 10.1016/j.cell.2024.08.007
成果:2024年10月31日,发表在Cell杂志上的一篇论文中,来自哈佛医学院等机构的一个科学家团队报道了一款小分子GSDMD激动剂,能够在肿瘤中刺激抗肿瘤免疫力,且无毒性。具体来说,在该研究中,研究人员对能够激活 GSDMD的化合物进行了高通量筛选,并鉴定出了DMB(6,7-dichloro-2-methylsulfonyl-3-N-tert-butylaminoquinoxaline)可作为一种直接的、选择性GSDMD激动剂。在小鼠肿瘤模型中,DMB诱导的脉冲和低水平焦亡抑制了肿瘤生长,而不损害表达GSDMD的免疫细胞。此外,研究显示,DMB诱导的抗肿瘤作用是免疫介导的,在缺乏淋巴细胞的小鼠中,这种作用会消失。研究还表明,DMB治疗可与抗PD-1疗法产生协同作用。毒性方面,DMB治疗未改变循环系统中促炎性细胞因子或白细胞数量,也未引起体重减轻。总结来说,该研究表明,小分子介导的内源性GSDMD激活可以作为一种开关,在治疗GSDMD阳性癌症时,产生有效的抗肿瘤免疫,而不会引起不必要的炎症或其他毒性。(推荐阅读:Cell:新型癌症免疫疗法——GSDMD激动剂)
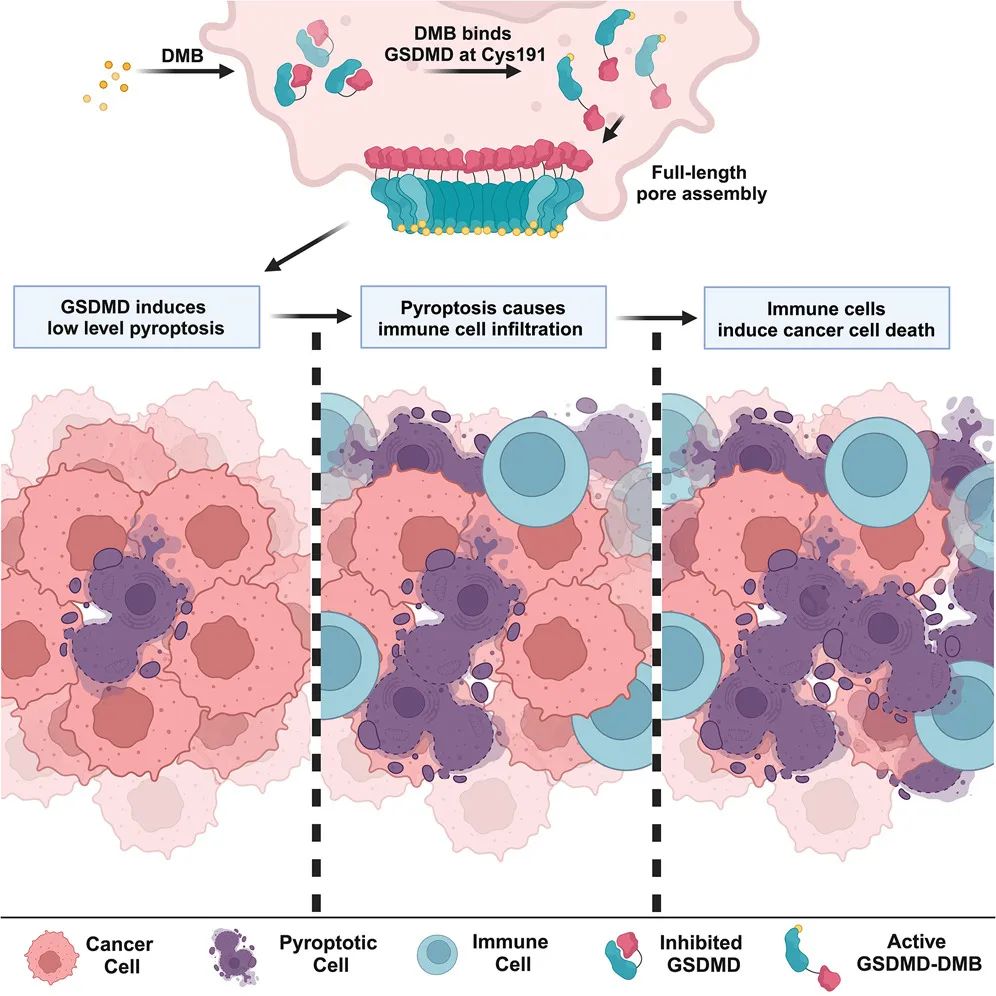
来源:Cell
里程碑靶点③:Transgelin 2
杂志:Nature
领域:癌症(CAR-T)
论文:DOI: 10.1038/s41586-024-08071-y
成果:治疗卵巢癌的一个重要障碍是肿瘤微环境。在这种肿瘤微环境中,T细胞失去了吸收脂质分子的能力,而脂质分子是其发动有效攻击所必需的能量。先前,研究人员关注到了一种名为脂肪酸结合蛋白5 (FABP5)的蛋白质,它有助于脂质摄取。2024年10月23日,发表在Nature杂志上的一项研究中,来自威尔康奈尔医学院的一个科学家团队发现,在患者来源的肿瘤标本和卵巢癌小鼠模型中,FABP5被困在T细胞的细胞质内,而不能移动到细胞表面,在细胞表面时它通常有助于从周围环境中吸收脂质。研究者们使用一系列生化分析来鉴定与FABP5结合的蛋白质。他们发现了一种名为Transgelin 2(TAGLN2)的蛋白质,它与FABP5相互作用,并帮助将其移动到细胞表面。进一步的实验表明,卵巢肿瘤抑制浸润性T细胞中Transgelin 2的产生。没有Transgelin 2,FABP5被困在T细胞的细胞质中,阻止脂质摄取,使T细胞无法攻击肿瘤。当研究人员在转移性卵巢癌的小鼠模型中测试CAR-T细胞时,他们发现了同样的问题——Transgelin 2表达受到抑制、脂质摄取受损。就像肿瘤微环境中的正常T细胞一样,工程CAR-T细胞也在细胞质中形成了FABP5缠结。因此,CAR-T细胞无法获得脂质以产生能量来有效攻击肿瘤(注:与传统CAR-T略有不同,该研究中使用的CER-T为chimeric endocrine receptor T cell,即嵌合内分泌受体T细胞,靶向的是促卵泡激素受体(FSHR),以杀伤FSHR阳性卵巢肿瘤)。为了解决这一问题,研究人员插入了一个修饰版的Transgelin 2基因。研究显示,升级后的CAR-T细胞在攻击卵巢肿瘤方面比原始的CAR-T细胞更有效。与缺乏TAGLN2的对照组相比,CER-TAGLN2 T细胞表现出了更好地控制转移性疾病进展的能力,用CER-TAGLN2 T细胞治疗可显著延长小鼠的生存期。(推荐阅读:Nature:“点燃”CAR-T,新靶点来了)
里程碑靶点④:IDO1
杂志:Science
领域:神经退行性疾病
论文:DOI: 10.1126/science.abm6131
成果:2024年8月23日,在发表于Science杂志上的一篇论文中,研究者们证实,通过抑制吲哚胺-2,3-双加氧酶1(indoleamine-2,3-dioxygenase 1, IDO1)来阻断患有阿尔茨海默病的实验室小鼠的犬尿氨酸途径,能够恢复健康的大脑代谢,进而改善甚至恢复认知功能。在阿尔茨海默病小鼠模型中开展的研究显示,IDO1抑制剂改善了海马的葡萄糖代谢,纠正了星形细胞的缺陷,并改善了小鼠的空间记忆。接下来,研究团队希望是在人类阿尔茨海默病患者身上测试IDO1抑制剂,看看它们是否在认知和记忆方面表现出类似的改善作用。(推荐阅读:Science:阿尔茨海默病新靶点——IDO1)
 来源:Science
来源:Science
里程碑靶点⑤:PTER
杂志:Nature
领域:肥胖
论文:DOI: 10.1038/s41586-024-07801-6
成果:2024年8月7日,发表在Nature杂志上的一项研究中,来自斯坦福大学医学院的Jonathan Long博士领导的科学家团队发现了一种独立于司美格鲁肽(Wegovy)等GLP-1减肥药作用机制的体重调节代谢途径,为开发新型抗肥胖药物指出了新的方向。具体来说,这项研究把重点放在了牛磺酸上。牛磺酸在肉类和贝类等富含蛋白质的食物中含量丰富,小鼠补充牛磺酸能够降低体重,增强运动表现。相反,通过基因工程使牛磺酸水平降低的小鼠表现出肌肉萎缩和运动能力下降。牛磺酸的一种代谢物被称为N-乙酰牛磺酸(N-acetyltaurine)。在这项研究中,科学家们发现,与BMI相关的一种名为PTER(phosphotriesterase-related)的酶是N-乙酰牛磺酸的水解酶,能将N-乙酰牛磺酸水解为牛磺酸和acetate。在小鼠中敲除Pter基因导致组织中N-乙酰牛磺酸水解活性完全丧失,小鼠血液和组织中N-乙酰牛磺酸水平系统升高。
当给Pter敲除小鼠喂食高脂肪食物,并在饮用水中添加牛磺酸时,相比对照组小鼠,Pter敲除小鼠吃得显著更少,体重更轻。研究还发现,体重的差异完全是由于基因敲除小鼠的脂肪量减少。接着,研究显示,当给肥胖野生型(未敲除Pter)小鼠喂食N-乙酰牛磺酸,也能以功能性GFRAL受体依赖的方式减少食物摄入量和体重(PTER通路独立于目前市场上的GLP-1受体激动剂采用的通路)。这些数据揭示了PTER和N-乙酰牛磺酸在体重控制和能量平衡中的作用,并证明了小鼠中Pter的基因敲除或N-乙酰牛磺酸给药能够抑制体重和肥胖。(推荐阅读:Nature:GLP-1之外,一种减肥“新疗法”)
里程碑靶点⑥:IL-11
杂志:Nature
领域:衰老
论文:DOI: 10.1038/s41586-024-07701-9
成果:2024年7月17日,发表在Nature杂志上的一项成果显示,一种促进炎症的蛋白质可能是延长健康寿命的关键。在中年小鼠中,阻断这种名为IL-11的蛋白能够促进新陈代谢,改善虚弱,并将寿命延长约25%。
具体来说,研究人员测试了来自年轻和年老小鼠的丰富样本,并发现,IL-11在年老小鼠的组织中始终更丰富,包括骨骼肌、脂肪和肝脏组织。当他们删除一些小鼠体内编码IL-11蛋白的基因时,这些动物的健康寿命(healthspan)得到了改善,比IL-11水平正常的小鼠寿命延长了24.9%。研究小组用一种抗体来阻断75周大的小鼠体内的IL-11,也得到了类似的结果(75周大的小鼠相当于55岁的人):小鼠代谢及肌肉功能改善,衰老生物标志物降低,虚弱改善,雄性小鼠平均寿命延长22.5%,雌性小鼠平均寿命延长25%。这些结果证明了促炎因子IL-11在哺乳动物健康寿命中的作用。(推荐阅读:Nature:小鼠寿命延长25%,抗衰老新靶点来了)
里程碑靶点⑦:WIZ
杂志:Science
领域:镰状细胞病
论文:DOI: 10.1126/science.adk6129
成果:镰状细胞病(SCD)是一种常见的、危及生命的疾病。目前,全世界有740万人患有SCD,且据估计患病率正在增加,每年有超过50万儿童出生时患有SCD。
通过治疗诱导胎儿血红蛋白(fetal hemoglobin, HbF)是该领域的重点研发方向。不过,目前开发安全、有效的HbF小分子诱导剂仍然难以捉摸。2024年7月4日,来自Novartis Biomedical Research的研究团队发表在Science杂志上的一项研究揭示,靶向转录因子WIZ(一种以前未被识别的HbF抑制因子)的分子胶降解剂dWIZ-1和dWIZ-2能够在成红细胞(erythroblast)中强烈诱导HbF,有望为开发治疗SCD的新药铺平道路。(推荐阅读:诺华发了1篇Science:关于「分子胶」)
里程碑靶点⑧:Osr2
杂志:Cell
领域:癌症(免疫疗法)
论文:DOI: 10.1016/j.cell.2024.04.023
成果:2024年6月20日,细胞应激生物学国家重点实验室、厦门大学生命科学学院/翔安医院周大旺与陈兰芬教授联合陆军军医大学免疫学研究所、昌平实验室的叶丽林教授课题组在Cell杂志上发表研究论文,揭示了在肿瘤组织纤维化和硬度增加的应激情况下,T细胞表面机械力感应受体Piezo1通过激活转录因子Osr2促进T细胞功能耗竭而无法杀伤肿瘤的重要机制。研究发现Osr2通过招募组蛋白去乙酰化酶HDAC3抑制CD8+T细胞效应基因表达导致其功能耗竭。CD8+T细胞中敲除Osr2或者使用HDAC3的抑制剂则能够有效缓解T细胞的耗竭并显著地抑制肿瘤生长。总结来说,该研究明确了Osr2作为一个响应机械刺激的转录因子,在肿瘤硬度微环境中加剧了CD8+T细胞的功能失调与耗竭,为Piezo1-Osr2信号作为肿瘤治疗靶点奠定了理论基础,有望为实体瘤治疗提供新思路。(推荐阅读:Cell:癌症免疫治疗新靶点——Osr2)
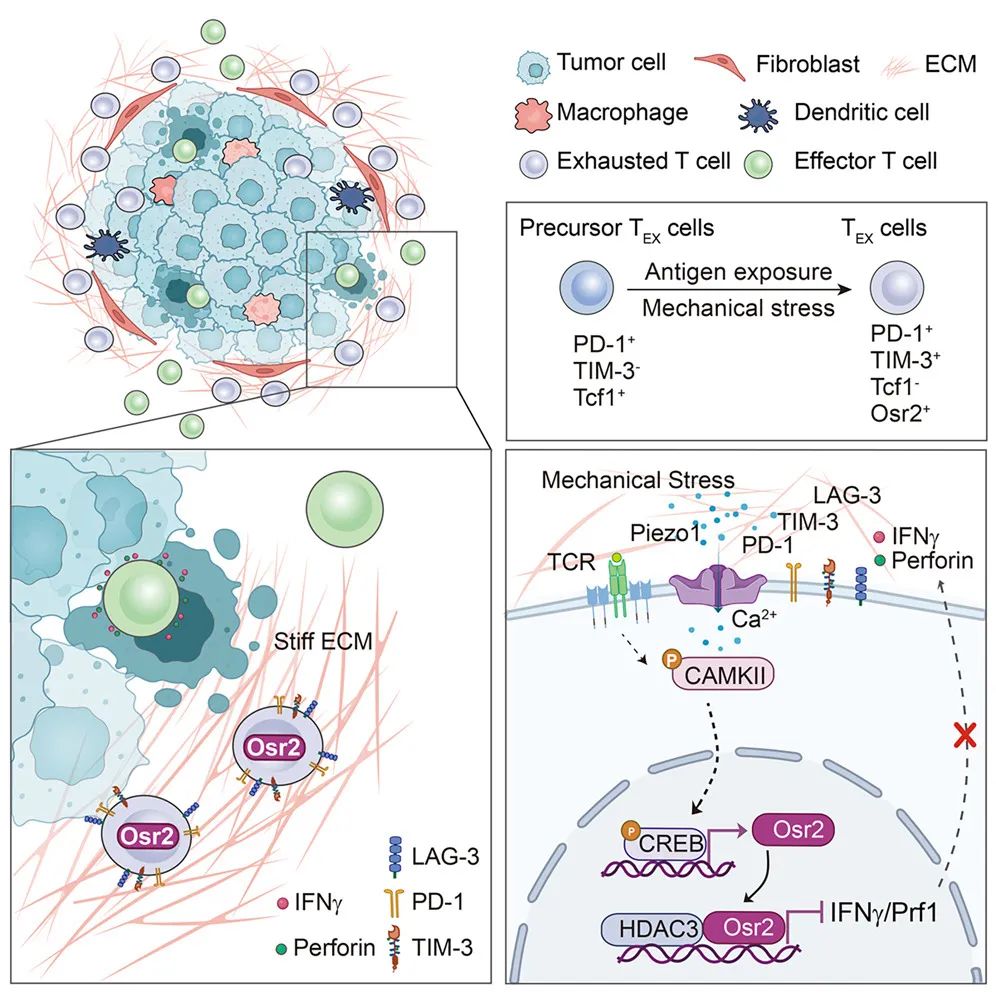
来源:Cell
里程碑靶点⑨:IGSF8
杂志:Cell
领域:癌症(免疫疗法)
论文:DOI: 10.1016/j.cell.2024.03.039
成果:2024年5月23日, 寻百会生物在Cell杂志发表论文,研究团队发现,IGSF8可以通过结合NK细胞上的MHC-I 受体:KIR3DL2(人)和Klra9(鼠),抑制NK细胞对肿瘤细胞的杀伤,在肿瘤细胞上敲除IGSF8可以提升NK细胞对肿瘤细胞的杀伤。利用公司特有的STEAD AI平台从头设计的针对人和鼠IGSF8都具有具有高亲和力的抗体IGSF8.06不仅可以阻断IGSF8与NK受体KIR3DL2和Klra9的相互作用,还可以增强NK细胞对不同种癌细胞的杀伤,且IGSF8.06抗体与PD1抗体的联用具有显著的协同效应。综上所述,IGSF8作为一个全新的免疫检查点,能够抑制NK细胞的细胞毒性,可以成为一个抑制肿瘤免疫逃逸的新靶点。相关项目GV20-0251(IGSF8抗体)已经进入临床开发阶段。
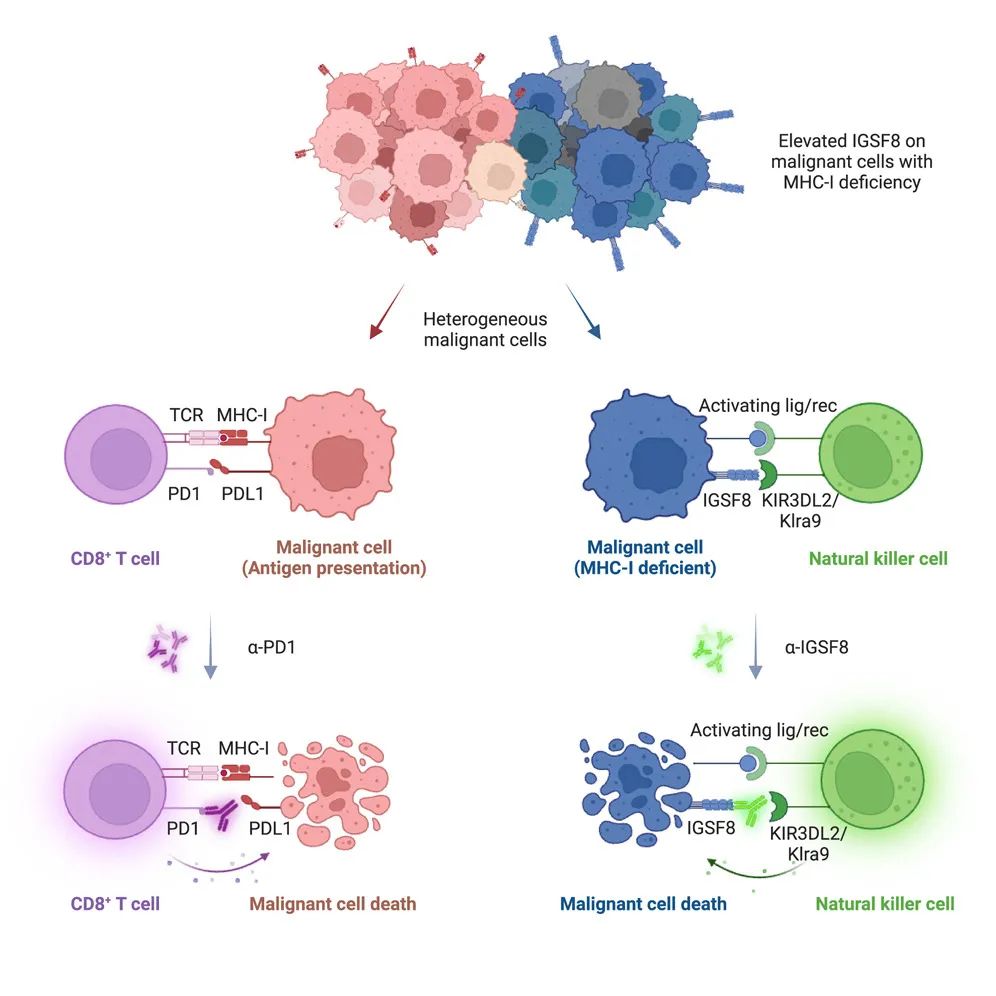 来源:Cell
来源:Cell
里程碑靶点⑩:STK33
杂志:Science
领域:男性避孕
论文:DOI: 10.1126/science.adl2688
成果:近几十年来,避孕方面的突破有限,特别是男性避孕药开发。2024年5月23日,来自贝勒医学院的科学家团队在Science杂志上发表一项突破成果。研究发现,一种靶向丝氨酸/苏氨酸激酶33(STK33)的小分子能够成功降低雄性小鼠的生育能力,且未显示任何安全问题。更重要的是,这种新型避孕疗法的效果是可逆的,小鼠在停止使用不久后就恢复了生育能力。未来几年,科学家们将在灵长类动物中进一步评估STK33抑制剂,以确定其作为可逆男性避孕药的有效性(推荐阅读:Science里程碑:男性避孕药,突破来了!靶向新靶点STK33,疗效可逆)。
里程碑靶点⑪:NMDA receptor
杂志:Nature
领域:肥胖
论文:DOI: 10.1038/s41586-024-07419-8
成果:2024年5月15日,丹麦哥本哈根大学诺和诺德基金会基础代谢研究中心的科学家在Nature发布一项关键临床前研究。他们开发的一款具有创新双重机制的在研减重药物——GLP-1-MK-801表现出比司美格鲁肽更优异的减重效果,有望为减重领域带来更进一步的突破。
GLP-1-MK-801分子是由NMDA受体拮抗剂(MK-801)与GLP-1类似物通过可裂解的二硫键连接而成。GLP-1-MK-801通过两种已知的减重相关信号通路,实现协同减重疗效。NMDA受体与神经递质分子谷氨酸结合时,在调节神经突触可塑性方面发挥着重要作用。基因测序分析显示,NMDA受体和谷氨酸信号传导也与肥胖有关。研究人员将GLP-1-MK-801与司美格鲁肽进行比较,发现GLP-1-MK-801具有更好的减重效果,并能更持久地减少小鼠的食物摄入。(推荐阅读:Nature:双剑合璧!超越司美格鲁肽,新型减肥药来了)
里程碑靶点⑫:CD3L1
杂志:Cell
领域:癌症(免疫疗法)
论文:DOI: 10.1016/j.cell.2024.03.019
成果:2024年4月25日,发表在Cell杂志上的一篇论文中,复旦大学生物医学研究院许杰团队联合柏全生物(BioTroy Therapeutics)等机构,在全球范围内首次报道了基于全新靶点CD3L1(CD3E ligand 1,ITPRIPL1)的抗体开发工作。该论文涵盖了CD3L1靶点发现与功能研究、药物发现与效果验证、宠物肿瘤治疗、组织病理学分析等完整转化医学研究。科学家们首先发现CD3L1的表达具备多方面的独特性质,包括其与PD-L1在肿瘤表达的互斥、在PD-1/PD-L1抗体疗效不佳的肿瘤中高表达、在免疫豁免器官睾丸高表达等。进一步的功能研究发现CD3L1对T细胞具有显著的抑制,其在肿瘤中的表达促进肿瘤的免疫逃逸。分子机制探究表明,CD3L1结合CD3E胞外区,并阻碍ZAP70与ERK的磷酸化,从而对T细胞的初始化激活发挥“刹车”作用。这项发现首次揭示CD3L1是CD3的天然配体,表明TCR/CD3复合物并非以TCR为主的“单极”调控方式,而是TCR和CD3都具有天然调控配体的“双极”工作模式。在揭示CD3L1: CD3免疫检查点信号轴的基础上,研究团队开发了CD3L1抗体这类全新的免疫检查点阻断剂(ICB),并在多种肿瘤模型中验证了CD3L1抗体激活T细胞及抑制肿瘤生长的作用。据悉,基于该原创性研究开发的CD3L1抗体用于治疗多种晚期实体肿瘤的临床试验已获美国FDA和中国NMPA许可。(推荐阅读:Cell重磅:全球首创CD3L1抗体问世,癌症免疫治疗迎来新突破)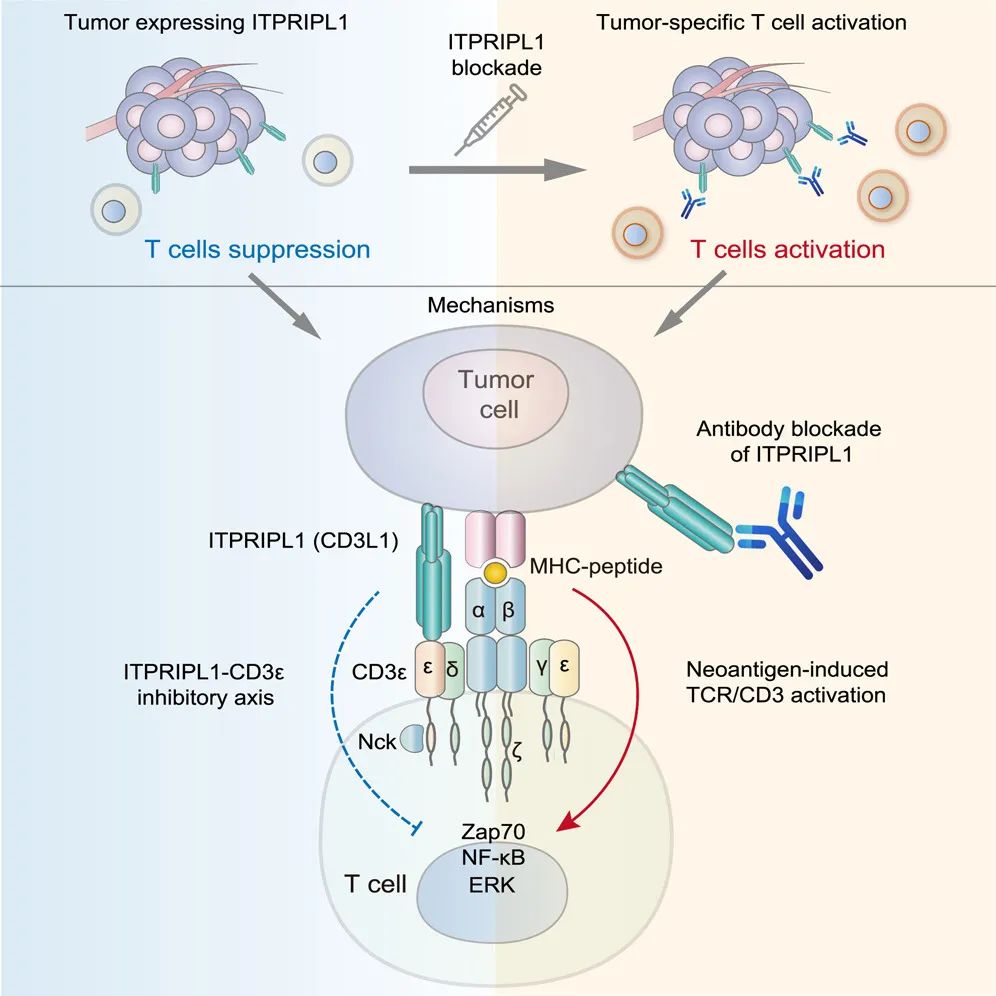
来源:Cell
里程碑靶点⑬:FOXO1
杂志:Nature
领域:癌症(CAR-T)
论文:DOI: 10.1038/s41586-024-07242-1; DOI: 10.1038/s41586-024-07300-8
成果:CAR-T细胞疗法已经革新了恶性血液肿瘤的治疗,并已在临床中应用多年,且带来了包括Emily在内的“治愈”惊喜。但这类突破性疗法仍存在一些瓶颈,其中包括如果长时间与癌细胞作战,最后会进入耗竭状态,失去战斗力。在治疗乳腺癌、肺癌等实体瘤时,让CAR-T细胞保持足够长时间的活性以消灭肿瘤仍是待攻克的难题。科学家们也一直在寻找能够帮助CAR-T细胞在患者体内存活更长时间的办法。2024年4月10日,两个独立研究小组同一天在Nature杂志发表论文,揭示了一种使CAR-T细胞增强活力的方法——使它们更像干细胞。两个研究小组都发现,CAR-T细胞如果经工程改造后表达高水平的特定蛋白(FOXO1),就能在体内存活更长时间,进而产生更强的抗癌活性。(推荐阅读:Nature里程碑:新靶点FOXO1来了,让CAR-T更持久、更有效)
里程碑靶点⑭:DCAF5
杂志:Nature
领域:癌症
论文:DOI: 10.1038/s41586-024-07250-1
成果:在许多癌症中,没有容易成药的靶点。通常,这些癌症是由缺失肿瘤抑制蛋白引起,由于蛋白的缺失,因此没有可以直接靶向的靶点。2024年3月27日,发表在Nature杂志上的一项研究中,科学家们致力于为由肿瘤抑制蛋白SMARCB1缺失引起的一系列侵袭性癌症寻找治疗方法。为了更好的了解SMARCB1突变的结果,研究将14个SMARCB1突变细胞系用于近全基因组的CRISPR筛选,并获得了一个重要发现:一种很少被研究的蛋白质DCAF5(DDB1–CUL4-associated factor 5)对缺少SMARCB1的横纹肌样肿瘤至关重要,可能是治疗这类癌症的潜力靶点。研究者们在小鼠模型中敲除了DCAF5基因或者降解DCAF5蛋白,结果非常令人意外,癌细胞恢复到了“非癌状态(non-cancerous state)”,且这种逆转可在小鼠模型中长期保持。
领导该研究的 Charles W.M. Roberts博士表示,无数类型的癌症由肿瘤抑制因子丧失引起,因此,他们希望,这项研究可以打开一扇门,让科学家们思考通过逆转癌细胞,而不是杀死癌细胞来靶向治疗癌症。(推荐阅读:Nature突破:神奇抗癌靶点DCAF5来了,或开辟癌症治疗新范式)
里程碑靶点⑮:SMARCAL1
杂志:Cell
领域:癌症(免疫疗法)
论文:DOI: 10.1016/j.cell.2024.01.008
成果:2024年1月31日,发表在Cell杂志上的一项研究中,来自哥伦比亚大学等机构的科学家们发现,肿瘤可以利用一种特殊的细胞蛋白——SMARCAL1来躲避免疫系统。SMARCAL1通过双重机制促进肿瘤免疫逃逸,包括抑制先天免疫信号及诱导PD-L1介导的免疫检查点反应。靶向SMARCAL1的药物可以对癌症造成双重打击,并使免疫疗法更加有效。该研究还分析了来自癌症基因组图谱(The Cancer Genome Atlas)的患者数据,发现SMARCAL1的高表达与较差的临床结果相关。这些研究结果揭示了SMARCAL1是癌症免疫治疗的一个有希望的靶点。(推荐阅读:Cell:癌症免疫治疗新靶点——SMARCAL1)
附:2024年值得关注的100个新靶点
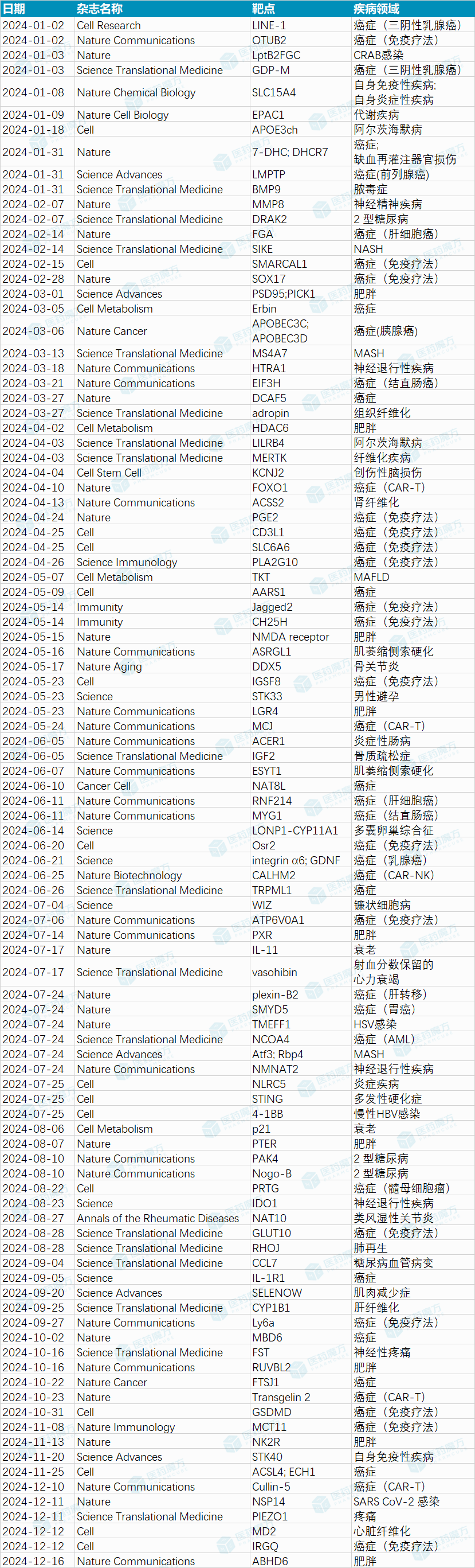
备注:本文新靶点定义为针对各类适应症的全新靶点以及发现新适应症、新应用的“老靶点”。