海南先行区临床急需进口药品医疗器械管理规定之主要内容简介
来源:法务合规管理总部 王小辉 | 发布时间:2023-05-26
2023年3月,海南省人民政府发布《海南自由贸易港博鳌乐城国际医疗旅游先行区临床急需进口药品医疗器械管理规定》(2023年16号文,以下简称“先行区临床急需进口药品医疗器械管理规定”),取代2019年4月2日印发的《海南博鳌乐城国际医疗旅游先行区临床急需进口药品管理暂行规定》(琼府〔2019〕16号)和2020年6月2日印发的《海南自由贸易港博鳌乐城国际医疗旅游先行区临床急需进口医疗器械管理规定》。
《先行区临床急需进口药品医疗器械管理规定》是落实2019年国务院四部委发布的《关于支持建设博鳌乐城国际医疗旅游先行区的实施方案》重要措施。
一、博鳌乐城国际医疗旅游先行区概述
2013年2月,国务院批准设立海南博鳌乐城国际医疗旅游先行区。2019年9月,四部委发布《关于支持建设博鳌乐城国际医疗旅游先行区的实施方案》。先行区的目标是在2025年实现医疗技术、装备、药品与国际先进水平“三同步”,主要主要措施包括:1、经批准,先行区医疗机构因临床急需可以使用国外已上市、国内未上市的药品;2、支持申报开展干细胞临床研究的前沿医疗技术研究项目;3、允许境外资本在先行区举办医疗机构,并逐步取消境外资本股权比例限制等;4、先行区内开展临床真实世界数据应用试点工作;5、临床急需药品可带离使用等。
二、《先行区临床急需进口药品医疗器械管理规定》主要内容
(一)真实世界数据作为申报材料
《先行区临床急需进口药品医疗器械管理规定》第五条规定:临床急需进口药械所产生的真实世界数据,符合我国药品和医疗器械注册申报相关要求的,注册申请人可将其作为申报资料。
乐城先行区临床真实世界数据应用试点工作自开展以来,已有青光眼引流管等多款药品医疗器械产品,通过使用乐城真实世界数据辅助临床评价获得国家药监局注册批准,加快了在中国的上市速。对于有需求的成员企业可申请参加相关试点,加速引入品种国内上市进度。
(二)医疗机构对临床急需进口药械使用安全风险承担主体责
《先行区临床急需进口药品医疗器械管理规定》第四条规定:指定医疗机构对临床急需进口药械使用安全风险承担主体责。
医疗机构对临床急需进口药械使用安全风险承担主体责主要包括以下几点:1、临床急需进口药品医疗器械只能在指定医疗机构使用;2、该指定医疗机构应为三甲医药;3、指定医疗机构需获得资格认定;4、指定医疗结构在临床急需进口药械追溯管理平台上递交临床急需进口药械的使用申请;5、使用临床急需进口药械造成患者人体伤害的,指定医疗机构按有关规定承担责任。如由于临床急需进口药械造成伤害的,由指定医疗机构先行赔偿,再根据法定或者约定向相关责任单位追偿。
(三)临床急需进口药械进口及使用流程
临床急需进口药械的进口、使用主要包括以下几个步骤:
1.提出申请。指定医疗结构在临床急需进口药械追溯管理平台上递交临床急需进口药械的使用申请;
2.卫健委审批。省卫生健康管理部门受理指定医疗机构提出的临床急需进口药械使用申请后,对1、是否属于临床急需药械,2、医疗机构科室或医疗团队是否具有使用能力进行评估;
3.省药监部门审批。省药监部门重点对产品境外上市情况、不良反应/事件发生情况等进行审查;
4.进口备案。口岸药品监督管理部门凭省药品监督管理部门批准文件按相关规定为指定医疗机构办理进口备案手续。
5.进口通关与流通。指定医疗机构应当委托持有《药品经营许可证》、《医疗器械经营许可证》的药械经营企业采购、进口和配送临床急需进口药品、器械,
6.储存与配送。受托的药械经营企业(以下简称受托经营企业)应当在经营许可范围内开展业务,按照经营质量管理规范的要求购进、储存、配送临床急需进口药械,并对临床急需进口药械经营质量安全承担责任,按要求建立药械不良反应/事件报告制度。
7.使用。(1)指定医疗机构、受托经营企业购进临床急需进口药械,应当与供货企业签订质量协议,明确各方质量责任。(2)指定医疗机构使用前应当向患者或者家属告知临床急需进口药械按临床急需进口批准、国内已上市品种无法替代或者治疗方案等情况,并与患者或者家属签署知情同意书等文件。
(四)带离使用
为方便患者院外使用药械,《先行区临床急需进口药品医疗器械管理规定》第十九条三款规定:指定医疗机构根据患者诊疗需求和产品特点,经充分评估,在确定安全、有效前提下,患者可将仅供自用、合理量、风险程度可控的临床急需进口药械带离使用。
2020年海南省药监局出台的《海南博鳌乐城国际医疗旅游先行区临床急需进口药品带离先行区使用管理暂行办法》规定,先行区医疗机构患者在出院时,医疗机构根据患者需继续使用临床急需进口药品的实际情况,制定患者出院带药方案及应急预案,经省卫健委审批和省药监局批准后,患者可将仅供自用、少量的口服临床急需进口药品带离先行区。同时,《暂行办法》还规定了一系列条件和要求,以确保带离使用的药品仅供患者自用。2022年,海南省药监局联合海南省卫健委又出台了《海南自由贸易港博鳌乐城国际医疗旅游先行区临床急需进口药品带离使用管理办法》,对前述《暂行办法》中的规定进行了优化调整,将药品带离使用的范围从口服药品扩大至外用、皮下注射药品,将药品带离使用的监管程序由审批制改为备案制。
在《先行区临床急需进口药品医疗器械管理规定》实施后,当地药监部门应该会进一步优化带离使用的范围、程序等内容,以方便患者享有先进药械。
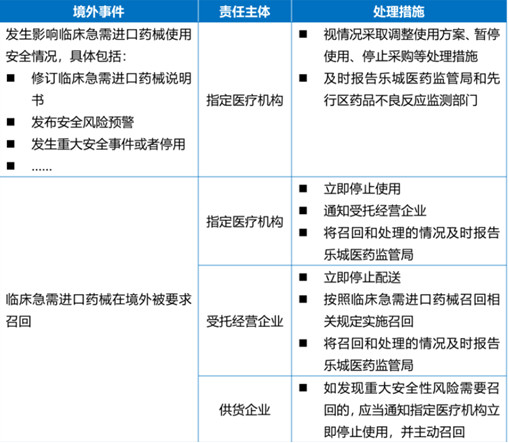
(五)境外使用与召回的应对措施
为保障用药、用械安全,《先行区临床急需进口药品医疗器械管理规定》也做出了相应的安排,详见下表:
(六)信息化追溯管理
为进一步保障药械使用安全、可追溯、可追责,《先行区临床急需进口药品医疗器械管理规定》规定了信息化追溯管理制度。
《先行区临床急需进口药品医疗器械管理规定》第二十五条规定:指定医疗机构、受托经营企业、先行区保税仓,应当使用省药品监督管理部门会同先行区管理部门建立的临床急需进口药械追溯管理平台对临床急需进口药械进行管理,制定信息化追溯制度,持续完善信息化追溯体系,做到临床急需进口药械的申请、采购、进口、配送、使用和不良反应/事件监测等全过程可追溯,确保来源可查、去向可追,依法承担药品质量安全相应责任。