新版《药品管理法实施条例》解读,来了
来源:GMP办公室 | 发布时间:2026-01-30
摘要:新版《药品管理法实施条例》将于2026年5月15日起施行,其核心变化在于重构了以药品全生命周期(从研制、注册到生产、经营、使用及监管)为主线的章节框架,并专设“药品上市许可持有人(MAH)”一章以明确其全链条质量安全责任核心地位。条例新增了多项关键制度,包括对创新药和罕见病用药设立市场独占期以激励研发、允许特定药品分段生产、明确网络药品销售的负面清单与平台责任,并大幅提升了对无证生产经营及网络违规售药等行为的处罚力度,体现了强化监管、鼓励创新与保障药品可及性的立法导向。
国务院 第828号令 正式公布了修订后的《中华人民共和国药品管理法实施条例》,自2026年5月15日起施行。该条例解读如下:整体情况
| 旧版 | 新版 |
| 10章 八十条 | 9章 八十九条 |
| 按企业类型(生产、经营、医疗机构)划分章节 | 按药品生命周期(研制→注册→MAH→生产→经营→使用→监管)划分章节 |
| 无MAH专章 | 专设”药品上市许可持有人”一章 |
| 单设”药品价格和广告的管理” | 删除该章,相关内容分散至各章 |
第一章 总则
新增核心原则:
- 以人民健康为中心:明确从事药品活动应”遵循科学规律和伦理原则,全面防控风险”(新版第2条)
- 产业高质量发展:新增国务院工信、商务部门制定产业发展规划和产业政策职责,强调”提升产业链韧性和安全水平”(新版第5条)
- 创新激励体系:国家完善创新体系,支持以临床价值为导向的研制,明确”促进中药传承创新”和”促进仿制药研发创新”(新版第3条)
第二章 药品研制与注册
旧版仅在第五章 药品管理 笼统规定,新版专设 第二章 药品研制与注册,系统构建注册管理体系:
| 新增核心制度 | 主要内容 |
| 非临床研究机构资格认定 | 需国务院药监部门批准,20工作日审批,证书有效期5年(第7条) |
| 临床试验受试者保护 | 明确不得向受试者收取临床试验费用(第8条) |
| 境外数据接受 | 境外研究数据符合规定的可用于注册申请(第10条) |
| 加快上市程序 | 明确突破性治疗药物程序、附条件批准程序、优先审评审批程序、特别审批程序(第15条) |
| 化学原料药审评 | 与制剂一并审评审批,颁发原料药批准证书(第16条) |
| 处方药转换 | 明确处方药与非处方药相互转换机制(第18条) |
| 市场独占期 | 儿童用药:新品种给予不超过2年市场独占期罕见病用药:承诺保障供应的给予不超过7年独占期(第21条) |
| 数据保护 | 新型化学成分药品数据保护期6年(第22条) |
第三章 药品上市许可持有人制度
新版第三章为全新增设,确立MAH作为药品安全责任核心:
- 质量管理体系:设立独立质量管理部门,配备生产负责人、质量负责人、质量受权人(独立履行上市放行职责)(第23条)
- 药物警戒体系:建立风险识别、评估和控制机制(第24条)
- 境外MAH代理人:境内指定责任人需在说明书中载明(第25条)
- 无障碍格式说明书:必须提供语音、大字、盲文或电子版本说明书(第26条)
- 上市后评价:未持续考察药品质量或未完成上市后评价的,再注册不予批准(第28条)
- 中药饮片/配方颗粒:中药饮片、配方颗粒生产企业履行MAH义务(第29条)
第四章 药品生产
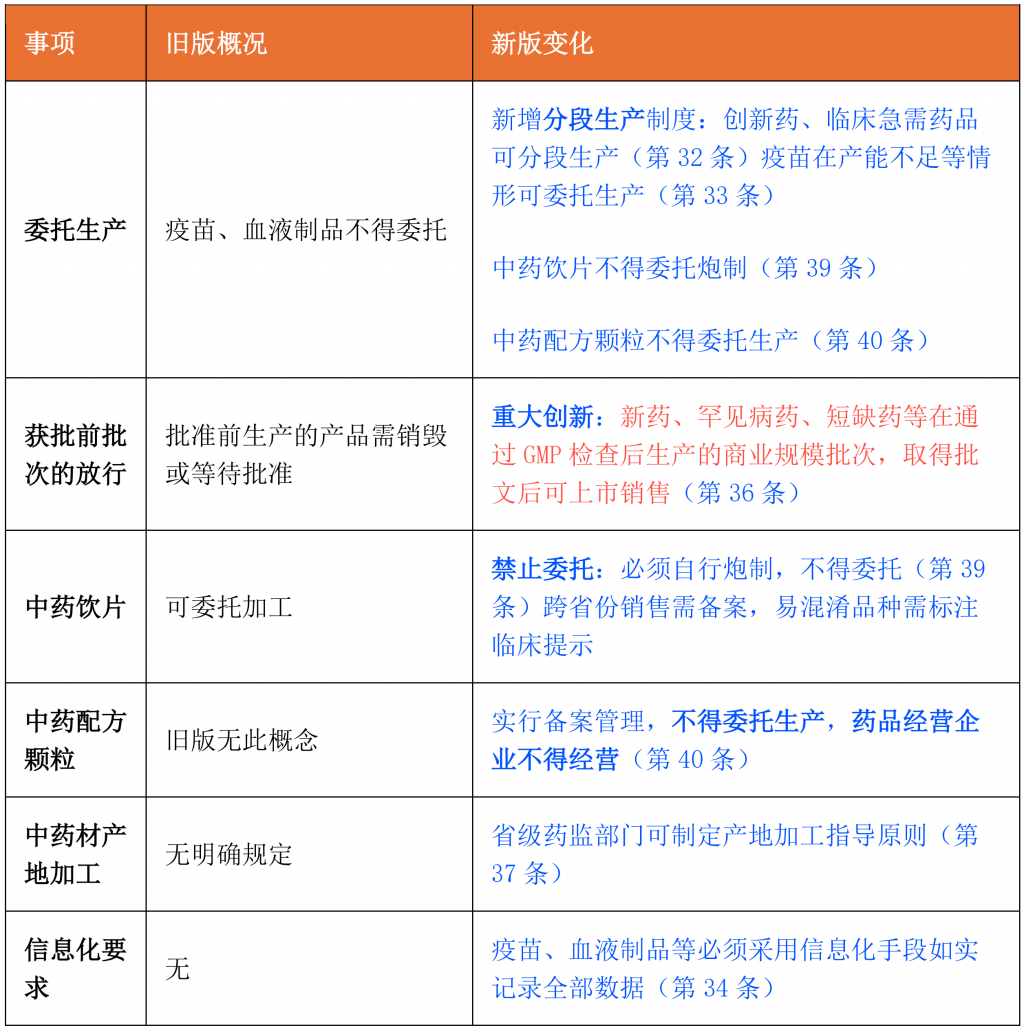
第五章 药品经营
- 网络销售监管(全新规定):明确第三方平台责任:需建立质量管理体系,配备药学技术人员(第45条)
- 负面清单:疫苗、血液制品、麻醉药品、精神药品、医疗用毒性药品、放射性药品、药品类易制毒化学品不得通过网络销售;其他高风险药品不得通过网络零售(第46条)
- 其他变化:
- 经营许可层级:旧版区分批发(省级)和零售(市级),新版统一为”县级以上”地方药监部门(第42条)
- 药师配备:只经营乙类非处方药的零售企业,可按国务院药监部门规定配备药学技术人员(不再强制要求执业药师)(第43条)
- 储存运输:明确委托储存运输的质量责任,需审核受托方能力(第44条)
第六章 医疗机构药事管理
- 传统工艺备案制:仅应用传统工艺配制的中药制剂,由审批改为备案(第55条)
- 制剂有效期:注册证书有效期由5年改为3年(第55条)
- 儿童用药制剂:临床急需的儿童用制剂纳入清单管理,支持医疗机构配制(第56条)
- 禁止制剂情形:明确7类不得作为制剂的情形,包括中药注射剂、毒性药品等(第57条)
- 调剂使用:灾情疫情急需时,跨院调剂审批时限压缩至5个工作日(第59条)
第七章 监督管理
- 全程追溯:国务院药监部门制定统一追溯标准,药品包装需赋予追溯标识(第64条)
- 补充检验方法:对可能掺杂掺假药品,可使用批准的补充检验方法(第69条)
- 假药认定:明确5种构成假药的具体情形(第71条)
- 风险控制措施:采取暂停生产等措施期间,不得发布广告(第70条)
- 抽检规定:明确对辅料、直接接触药品的包材可进行抽查检验(第66条)
第八章 法律责任
新增处罚情形:
- 销售批准前生产的商业规模批次产品(第79条)
- 中药饮片委托炮制、配方颗粒委托生产(第79条)
- 经营中药配方颗粒、医疗机构制剂(第79条)
- 网络销售禁售药品(第79条)
- 第三方平台未建立质量管理体系(第84条)
处罚力度提升:
- 无证生产经营、网络违规售药等罚款为货值 10 – 20 倍(不足 10 万按 10 万算)(第79条)
- 提供虚假证明、数据、资料、样品或者采取其他欺骗手段骗取许可的:10年内不受理申请,罚款50万-500万元;情节严重对责任人禁业10年(第82条)
- 拒不执行风控措施:处货值金额5-10倍罚款,可吊销许可证(第85条)
删除内容
删除:“药品认证”(GMP/GSP认证)的详细程序。删除:药品价格监测、药品广告审批等与《广告法》《价格法》衔接的内容。删除:“首次在中国销售的药品”等定义性条款。