2025年11月全球新药研发、注册及交易重点事件
来源:医药魔方 | 发布时间:2025-12-31
摘要:当月全球收录 19 条新药重大研发进展(2 条获批上市、17 条临床重大进展),其中 Otsuka 的全球首创抗 APRIL 疗法斯贝利单抗获 FDA 加速批准用于成人原发性 IgAN 降低蛋白尿(基于 VISIONARY 3 期中期数据,国内 9 月已申报上市,还在研干燥综合征适应症),诺和诺德口服司美格鲁肽治疗早期阿尔茨海默病的 2 项 3 期试验未达主要终点(但生物标志物有改善,股价开盘跌超 9% 并终止扩展试验);交易方面,全球共 118 笔交易(总金额 171.96 亿美元),中国相关 42 笔(总金额 34.81 亿美元),重点交易包括药捷安康与 Neurocrine 达成 8.815 亿美元 NLRP3 抑制剂授权合作(前者保有大中华区权益,核心产品 TT-02332 拟 2025 年底启动 I 期)、Manifold Bio 与罗氏超 20 亿美元合作开发血脑屏障穿梭载体(罗氏付 5500 万美元首付)、默沙东 92 亿美元收购 Cidara 以囊获其长效流感药物 CD388 及 Cloudbreak 平台;此外,报告还统计了全球获批新药(如韩国苯巴那酯、美国 MT1621)、特殊审评资格(如康方生物依沃西单抗获中国 BTD)及肿瘤领域新发起核心临床等数据。
医药健康领域正经历深度变革,无论本土药企、跨国巨头还是创新Biotech,精准把握全球研发与市场动向已成为竞争关键。《全球新药月报》帮助业界快速获取全球药企最新研发情报,掌握交易动向。报告主要聚焦以下内容:

一、上月全球新药研发进展根据公开资料不完全统计,截止到2025年11月30日,医药魔方为大家收录到了最近的全球新药重大研发进展共计19条。其中涉及药物获批上市信息2条,临床重大进展17条,具体信息展示如下:

first-in-class APRIL疗法 FDA加速批准斯贝利单抗 (Voyxact) 用于成人原发性IgAN
2025年11月25日,Otsuka 宣布FDA加速批准斯贝利单抗 (Voyxact) 用于降低有疾病进展风险的成人原发性IgAN患者的蛋白尿。此次批准基于VISIONARYᅠ3期中期分析,该分析显示,在9个月的治疗中(n=320),斯贝利单抗使蛋白尿显著降低51%(P<0.0001)(斯贝利单抗-50% vs 安慰剂2%)。该适应症的持续批准可能取决于正在进行的VISIONARY 3期研究中临床益处的验证,eGFR数据预计将于2026年初公布,以支持FDA的常规批准。
信息补充:
- 斯贝利单抗是首个也是目前唯一一个获批的阻断A-PRoliferation-Inducing-Ligand (APRIL) 的疗法。此外,斯贝利单抗用于治疗IgAN已于今年9月在国内申报上市。Otsuka目前还在开展一项2期试验,以评估斯贝利单抗用于干燥综合征的疗效性和安全性,预计将于2027年读出数据。
- 根据医药魔方NextPharma®数据库,目前处于临床阶段的在研靶向APRIL疗法如下:

注册性临床失败 Novo Nordisk宣布口服司美格鲁肽治疗早期阿尔茨海默病3期Evoke、Evoke+试验未达到主要终点
2025年11月24日,Novo Nordisk公布了口服司美格鲁肽治疗早期阿尔茨海默病患者的Evoke和Evoke+3期试验的顶线结果。两项试验均未达到CDR-SB主要终点,但观察到阿尔茨海默病相关生物标志物的改善。Evoke和Evoke+试验的更多初步结果将于12月3日在CTAD会议上公布。
信息补充:
- NovoᅠNordisk基于非临床研究、真实世界数据以及3项大型心血管结局试验的事后分析,开展了Evoke、Evoke+试验。动物模型研究发现,GLP-1可改善记忆功能,减少p-tau积累,司美格鲁肽具有降低可能影响认知和功能的神经炎症指标的能力。真实世界证据显示GLP-1治疗后痴呆的风险可能降低。在对Novo Nordisk(LEADER、SUSTAIN6和PIONEER6)进行的三项大型心血管结局试验数据的事后分析中,这些试验包含15,820名2型糖尿病患者,中位随访时间为3.6年,共识别出47名痴呆患者,其中32人服用安慰剂,15人服用GLP-1(利拉鲁肽或司美格鲁肽)。GLP-1 的痴呆发生率显著降低了53%。
- 试验结果公布后, Novo Nordisk股价开盘下跌超9%,原计划的1年扩展试验也将被终止。
二、上月全球新药交易进展
2025年11月全球共计发生118笔交易,首付款金额5.91亿美元,交易总金额171.96亿美元。其中中国相关交易共计42笔,首付款金额0.95亿美元,交易总金额34.81亿美元。
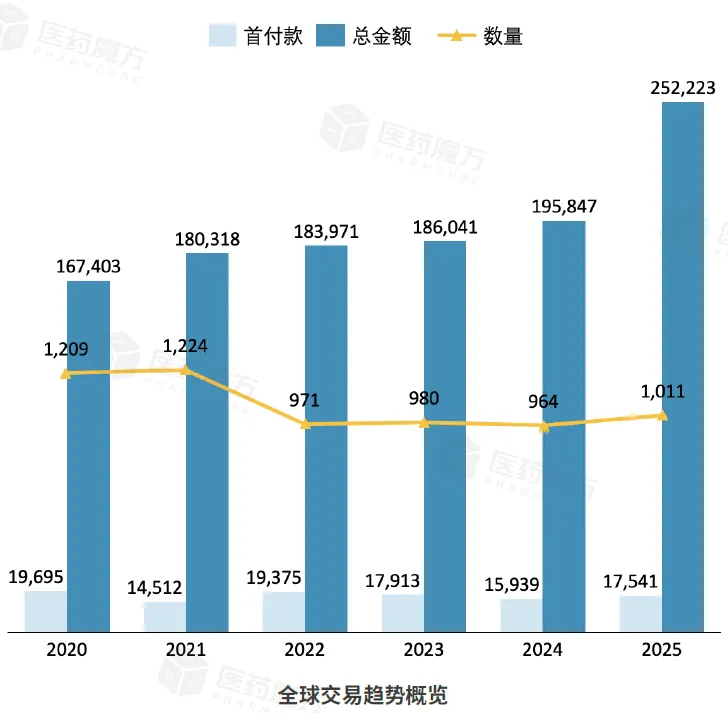
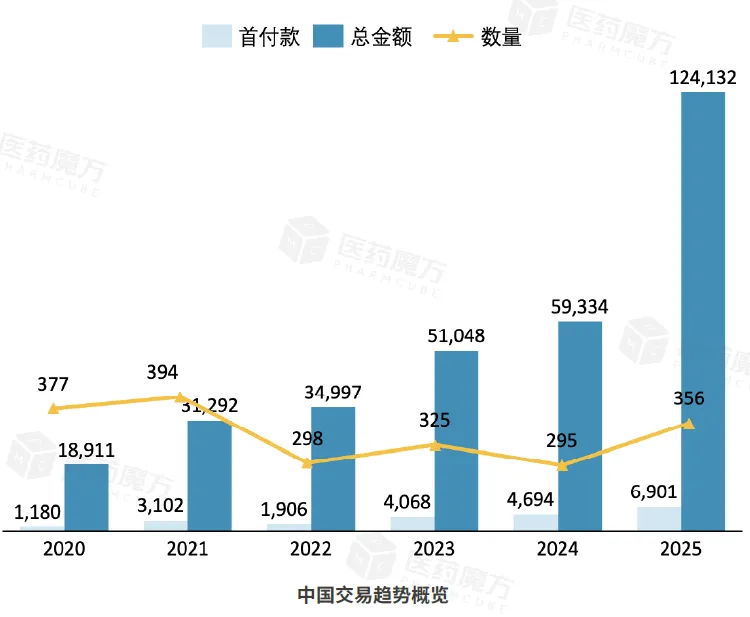
数据说明:统计时间截至2025年11月30日
医药魔方依据产品、交易金额、企业等因素收录了其中19笔重点交易: 其中涉及国内交易共7笔,涉及境外交易共8笔;另外还收录了4笔重大并购事件,具体信息展示如下:

国内交易 药捷安康与Neurocrine达成8.8亿美元NLRP3抑制剂授权合作
2025年11月3日,药捷安康与Neurocrine Biosciences(简称Neurocrine)订立了一项付特许权使用费的专利转让及研究合作协议,以开发NLRP3抑制剂用于治疗多种疾病。根据该协议,Neurocrine获授予在大中华区以外开发、制造及商业化药捷安康 NLRP3 药物平台中的NLRP3 抑制剂的独家权利,药捷安康拥有在大中华区(内地、香港、台湾、澳门)开发、制造及商业化NLRP3抑制剂的权利。该协议的总潜在价值为8.815亿美元,药捷安康将有权获得预付款,并且根据Neurocrine的开发和商业化进展,药捷安康可能会收到与研发里程碑和销售里程碑相关的进一步里程碑付款。该协议进一步涵盖订约方之间的研究合作,以进一步发展NLRP3相关技术。
相关信息:
- TT-02332是一款靶向NLRP3炎症小体的不可逆VAP-1抑制剂,旨在治疗非酒精性脂肪性肝炎(NASH)及其他代谢性与炎症性疾病。其作用机制是通过抑制NLRP3炎症小体的过度活化,从而有效减少关键炎症因子(如IL-1β和IL-18)的释放,调控免疫反应,改善代谢紊乱。目前,该药物已完成临床前研究,在体外和体内药效学模型中均显示出对NLRP3依赖性炎症的显著抑制作用。TT-02332具备多重优势:其高选择性避免了对其他NLRP亚型的脱靶效应;低脑渗透性的特点有助于降低中枢神经系统相关的副作用风险;同时,口服给药的方式为需要长期治疗的慢性代谢性疾病患者提供了便利。
- 在全球竞争格局中,进入NASH临床阶段的VAP-1抑制剂仅有三款,TT-02332是中国唯一处于临床前阶段的同类候选药物,面对中国约4,400万NASH患者的巨大市场潜力,其先发优势显著。根据计划,药捷安康将积极推进TT-02332的新药临床试验申请,并预计于2025年底启动I期临床试验,以评估其在人体的安全性、耐受性及剂量反应。
- 药捷安康成立于2014年,2025年在香港联交所主板上市,是一家以临床需求为导向、处于临床阶段的生物制药公司,专注于开发针对肿瘤、炎症及心脏代谢疾病的小分子疗法。公司研发管线丰富,拥有多款临床阶段候选药物。其核心产品替恩戈替尼是一款用于治疗胆管癌、前列腺癌等实体瘤的创新药,目前已进入国际多中心III期临床试验阶段,其中中国的胆管癌注册II期试验预计于2025年下半年完成。此外,肿瘤管线还包括针对复发/难治性B细胞淋巴瘤的TT-01488(中国I期试验显示客观缓解率高达57%),以及用于实体瘤的AXL/FLT3抑制剂TT-00973(其初步临床数据已在2025年ASCO年会上展示)。
国外交易 Manifold Bio与罗氏达成超20亿美元合作,利用AI平台开发血脑屏障穿梭载体
2025年11月3日, Manifold Bio(简称Manifold)宣布与罗氏达成一项战略研究合作和许可协议。该合作旨在利用Manifold专有的组织靶向穿梭组合和mDesign AI驱动的体内发现引擎,开发针对神经系统和神经退行性疾病的多个下一代血脑屏障(BBB)穿梭载体。根据协议条款,Manifold将主导研究和发现活动,以识别和开发针对罗氏选定治疗有效载荷的新型BBB穿梭载体,罗氏将主导临床前、临床和商业化工作。罗氏将向Manifold支付5500万美元的首付款。此外,Manifold还有资格获得总计超过20亿美元的研发、发现、临床和销售里程碑付款,以及分级特许权使用费。Manifold保留共同资助一个项目的开发权,以换取更高的特许权使用费,并保留将其BBB穿梭载体应用于罗氏许可目标以外的治疗有效载荷的权利。此次合作对于Manifold来说是一个基础性伙伴关系,有助于其作为一家独立的生物制药公司发展。
相关信息:
- Manifold的技术平台核心在于其AI驱动的体内发现引擎mDesign。该平台脱胎于哈佛大学George Church博士实验室,其独特优势在于融合了人工智能指导的蛋白质设计与高通量体内筛选能力,从而显著提升了血脑屏障穿梭器的开发效率与成功率。与依赖体外模型的传统研发路径不同,mDesign平台通过DNA条形码技术,可对数千至数百万种蛋白质变体进行并行标记与追踪,并直接在活体模型中进行大规模、在体的功能筛选与验证。这种方法能够获得更具生理相关性的递送数据,极大地优化了候选分子的筛选过程。
- 基于mDesign平台,Manifold已系统性地对数千种潜在BBB穿梭器进行了定量表征与优化。这些穿梭器可靶向多种内源性受体介导的转运通路,进而实现治疗性大分子(如抗体、siRNA、反义寡核苷酸等)的高效脑内递送,有效提升药物在靶组织的富集度与治疗窗口。该技术不仅适用于抗体药物,也具备与多种治疗模式偶联的灵活性,拓宽了中枢神经系统疾病治疗的候选药物范围。这一技术平台代表了一种前沿的研发范式,即从传统的“强行穿透”血脑屏障的策略,转向利用大脑内皮细胞上天然存在的转运通路进行特异性递送,为解决神经药物研发中的核心递送瓶颈提供了有力工具。
- 在脑靶向治疗领域中,BBB递送技术路线经历了从早期的非特异性穿透策略,到现今以受体介导转运为代表的精准递送方式的演进。研发手段也同步升级,从依赖体外模型筛选逐步转向人工智能引导的高通量体内筛选。这一系列技术进步,正逐步克服血脑屏障这一关键的生物学挑战。
收并购 默沙东以92亿美元收购Cidara Therapeut ics,囊获长效流感药物
2025年11月14日,默沙东宣布已与Cidara Therapeutics达成最终协议,以每股221.50美元现金的价格收购Cidara的所有流通股,总交易价值约为92亿美元。此次收购旨在扩大默沙东的呼吸道产品组合,核心资产是Cidara的领先候选药物CD388。CD388是一种潜在的同类首创、长效抗病毒药物,设计用于预防高风险人群的流感,目前正在进行III期ANCHOR研究,并已获得美国FDA的突破性疗法认定。
相关信息:
- Cidara正在利用其专有的Cloudbreak平台开发药物-Fc偶联物(DFC),即将靶向小分子和肽与抗体片段(Fc)偶联。这些“单分子鸡尾酒”可以被设计用来抑制特定的疾病靶点,并在需要时同时激活免疫系统。
- CD388是一种处于研究阶段的药物-Fc偶联物(DFC),由多个拷贝的强效小分子神经氨酸酶抑制剂与人类抗体的专有Fc片段稳定偶联而成。CD388旨在对所有已知的季节性和大流行性流感毒株提供通用保护,单次皮下或肌肉注射就有可能提供长达一个季节的保护。CD388非疫苗,活性不依赖免疫反应,具备通用保护性。
三、上月重点数据统计
1、全球获批新药统计
收录范围:主要统计上月中欧美日药监局首次批准以及补充批准的创新药和微创新数据
数据来源:医药魔方NextPharma数据库

2、全球特殊审评审批资格统计
收录范围:主要统计上月中欧美日药监局授予BTD/FTD/ODD/RPDD/RMAT/QIDP/Priority Review的创新药和微创新药品
数据来源:医药魔方NextPharma数据库

3、肿瘤领域新药发起核心临床统计
收录范围:仅统计上月肿瘤领域发起的创新药/微创新的注册性临床试验
数据来源:医药魔方TrialiCube数据库
