关于以患者为中心药物开发的见解——现有药物评价体系的重要补充
来源:中国食品药品监管杂志 | 发布时间:2024-05-13
摘要 Abstract
医疗实践不仅需要拥有科学的量化研究, 同时需要具有人文理念的质性研究; 不仅要能够处理数据为主的自然科学问题, 也要能分析主观信息为主的人文科学问题。而在以证据为基础的医学时代,治疗手段的获益- 风险评估格外重视证据的客观性,忽略患者一些主观性的证据,但在临床需求未被满足的情况下,需要患者声音。本文通过分析患者声音的内涵,结合我国临床药物开发现状和FDA 目前的相关实践,以及如何科学收集患者观点,对我国以患者为中心的药物开发提出展望。
Medical practice requires not only scientific quantitative research, but also qualitative research with humanistic concepts; it must be able to not only deal with data-based natural science issues, but also analyze human science issues based on subjective information. In the era of evidence-based medicine, the benefit-risk assessment of medical treatment pays special attention to the objectivity of evidence and ignores subjective evidence coming from patients. But when there are unmet clinical needs, patients’ voices are needed. This article analyzes the connotation of patients’ voice and the current status of clinical drug development in China, introduces practices of the US FDA on patient-focused drug development and methods to scientifically collect patient opinions, and puts forward suggestions for promoting patient-focused drug development in China.
关键词 Key words
药物开发;患者声音;临床价值;获益- 风险评估
drug development; patient voice; clinical value; benefit-risk assessment
01 前 言
患者是疾病治疗的主体,但对于治疗结局的评估,是由临床医生决定,而非患者自己。一种药物,如果在延长患者生存时间的同时,降低了患者的生活质量,这个药物是否比其他药物更具有临床价值?药物的临床价值应该是临床医生判断还是患者判断?在肿瘤药物开发过程中,客观缓解率是一种直接衡量药物抗肿瘤活性的指标,总生存期(OS)是迄今为止评价抗肿瘤药物最可靠的临床试验终点,通常是首选终点。然而,在癌症治疗过程中,疲惫和疼痛是患者的普遍症状,如果一种药物在不延长生存期的情况下,能够缓解疾病和治疗带来的疲惫和疼痛,提高患者生活质量,那么对于患者来说也是具有价值的。
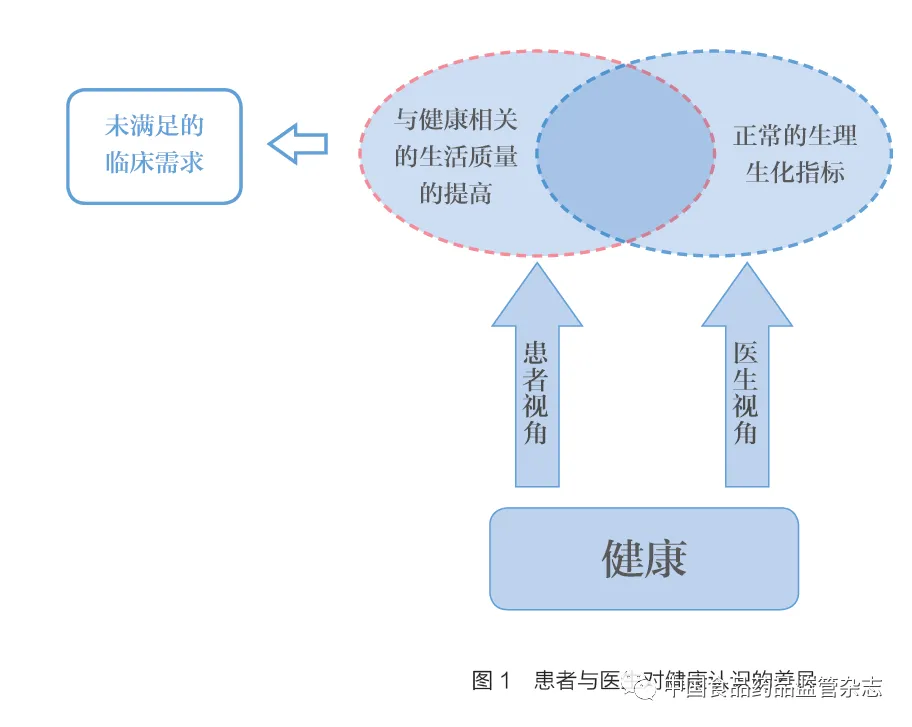
在医学实践中,经典的希波克拉底誓言中提及为病人谋幸福是其唯一目的,幸福是一个多维的概念,幸福除了患者的生理因素,还有患者的主观感受。当前的医学治疗是将患者的健康转化成一系列客观的测量值,这样的医学实践会有一定的局限性:治疗过程中,患者健康由一系列客观的数字定义,而忽略患者在治病过程中的主观感受。如图1 患者与医生对健康认识的差异所示,临床医生视角下的健康是正常的生理生化指标,但当患者的生活质量没有明显的提升时,其临床需求即未被满足。因此,在医学实践过程中除关注客观指标的变化外,还需要关注患者声音,从患者声音中提取有价值的信息,为药品开发和监管决策提供依据,更好地体现药物的临床价值。
02 患者声音中的价值信息
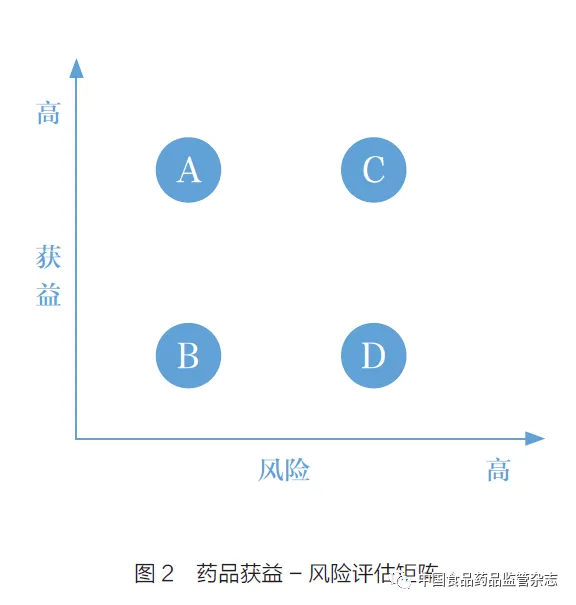
如图2 所示,在药品获益- 风险评估矩阵中,存在着A(高获益- 低风险)、B(低获益- 低风险)、C(高获益- 高风险)和D(低获益- 高风险)四种情况,最理想的情况是A。当出现B 和C 两种情况时,很难进行获益与风险评估,这时就需要患者发声,了解患者对风险的承受程度,进行权衡取舍。从患者角度出发,可以了解真实的临床需求,确定患者对于不良反应的忍受程度,为治疗手段提供评估获益与风险的信息,确定其临床价值。
2016 年9 月,一种治疗迪谢内肌营养不良症的药物成为FDA 历史上最具争议的批准药物之一。该药最初由于临床获益不充分而未得到批准,但这一结论遭到患者群体的强烈反对,他们认为临床试验数据不能有效传达患者所体验的益处,并且该药在合理的程度上可能预测获益,最终该药获得批准。FDA 将于2021 年对该疗法进行重新审查。当患有威胁生命的疾病而无有效的治疗方法时,患者已经明确表示,他们愿意在具有不确定性的情况下尽早获得治疗。当患者实际上没有其他治疗选择时,较大的不确定性是可以接受的。
在患者声音中包含了三个不同层次的信息:疾病症状的负担、患者治疗的负担,以及患者对于临床评价指标的理解。
2.1 疾病症状对患者的负担
在临床中,疾病症状几乎完全基于临床医生对患者症状的印象,而不是基于患者本人的第一手报道。临床医护人员获取、解释和报告患者症状,过程繁琐并且容易受到转录错误和遗漏的影响。有研究表明患者自我报告比临床医生的报告对患者功能状态的潜在变化更敏感,并且在治疗过程中能够更早地发现症状。研究人员通过审查书面病例而提取的症状很难代表患者真实的症状。比如银屑病,对其严重程度的评估是通过病变部分覆盖全身面积的比例来衡量的,但患者认为斑块的覆盖位置可能比覆盖程度更重要。在公众场合,裸露位置会影响患者的形象。因此,对于患者而言,目睹其可见皮肤区域的改善可能比病变部分占比的改变更为重要。
2.2 患者对于临床评价指标的理解
在药物开发过程中,评估药物临床标准的指标大多由研究者制定,缺少患者见解。一项关于慢性阻塞性肺疾病(COPD)的研究发现,除了呼吸困难和病情加重以外,咳嗽和黏痰的产生,对患者来说也是十分重要的症状。咳嗽症状和过多的黏痰是患者面临的特殊问题,症状在夜间很明显,平躺的时候,黏痰会积聚引起窒息感,并伴有咳嗽,导致睡眠障碍。传统上,三期临床评价COPD 药物安全性和有效性的临床终点主要是第1 秒用力呼气量(FEV1)基线的变化,FEV1是判断COPD 患者呼吸困难的指标。中度COPD 患者与重度COPD 患者相比,更有可能影响其生活的是咳嗽和黏痰等症状。开发能够解决咳嗽和黏痰等症状的疗法,以补充支气管扩张药和皮质类固醇的使用,这对于有这些症状的患者亚组来说十分重要。严格收集患者的意见,可以指导COPD 临床研究的设计,改进临床试验方法,使临床评价指标更能体现临床价值,为患者群体带来更好的治疗效果。
2.3 治疗对于患者的负担
许多慢性疾病的治疗需要患者投入大量的时间和精力,对患者造成负担。这种负担通常是由复杂的治疗方案导致的,其中包括与医护人员沟通、接受检查、进行治疗,以及改变饮食和锻炼习惯。在一些疾病无法治愈的情况下,增加患者治疗负担会导致患者对治疗方案不满意,降低药物的依从性,最终导致治疗失败。因此,减轻患者的治疗负担可以改善依从性,增加患者对于治疗方案的满意度,进而对疾病治疗起到积极作用。有研究表明,COPD 患者担心服用多种药物时会发生相互作用,并且对使用雾化器耗时长感到恼火。25% 的患者表示尽管感觉药物无效,但仍要服药,这会对治疗产生负面影响,此时减少药物使用也是有价值的。
2.4 总结与思考
患者对自身疾病有着独特的见解,但在真实的临床试验中,研究者不一定从患者的角度出发,更多的是从病情的角度出发。研究者对病情的判断主要是参照各项检查化验结果,结合通过口头询问患者得到的一些主要症状的改善情况,最后应用好转、治愈、恶化等定性指标表达病人的健康状况。患者声音在这一过程中的缺失,使得患者真实需求不能得到了解,开发出的药物也不能充分满足患者需求。同时,严格的纳排标准使受试者过于理想,无法体现药物在真实世界的疗效。因此,药物开发需要收集患者声音,充分了解患者需求,加强对患者疾病历程的理解,根据患者声音中的需求改进未来临床试验的方法,做到以患者为中心,为医生和患者提供最佳治疗方法。
03 FDA以患者为中心的药物开发相关实践
美国FDA 充分认识到患者参与药物开发的重要意义,于2012 年根据《处方药使用者付费法案》(PDUFA)的第五次授权,发起了以患者为中心的药物开发(patient-focused drug development,PFDD) 计划。在2016 年颁布的《21世纪治愈法案》(21st Century Cures Act)支持下,PFDD 成为FDA 的一项优先事项。了解FDA 当前的做法可以为我国收集患者声音、促进PFDD 实践提供借鉴。
3.1 患者观点数据来源
根据《21 世纪治愈法案》第3001条,在2017 年6 月之后提交的新药申请中,需要包含用于审评的患者体验数据(Patient Experience Data,PED) 及相关信息,且FDA 需公开该信息。PED是指由患者、患者的家庭成员及护理人员、患者权益组织、疾病研究机构、研究人员以及药品生产企业收集的有关患者疾病或状况的经验信息,包括疾病或相关治疗对患者生活的影响,以及患者对治疗的偏好。2018 年,FDA 批准的59 种新分子实体(NME)中,有48 种NME的审评报告中包含一份说明是否在审评过程中使用了PED 信息的表格。表格显示,在这48 种获批的产品中,有34 种(70.8%)在审评过程中使用了PED。患者报告结局(PRO)是PED 的最重要来源,在48 种获批产品中,有29 种(60.4%)在审评过程中应用了PRO。根据FDA 的释义,PRO 是任何直接来自于患者对自身健康状况的报告,其中不包括临床医生或其他任何人对患者反应的解释。当两种治疗效果仅有细微差别时,PED 数据可以提供有价值的参考。目前FDA 已经将PRO 测量的内容纳入药品、生物制品和医疗器械的审批流程中。FDA 提出PED 可以在各种环境中收集,包括临床试验、观察性研究、顾问委员会、会议( 如PFDD 会议) 和其他环境( 如社交媒体),保证PED 来源的多样性。
3.2 患者参与的方法
PFDD 会议是以患者为中心药物开发的重要组成部分,主要目的是促进患者参与药物开发,了解患者真实需求。PFDD 会议分为由FDA 主导和由外部主导两种类型。
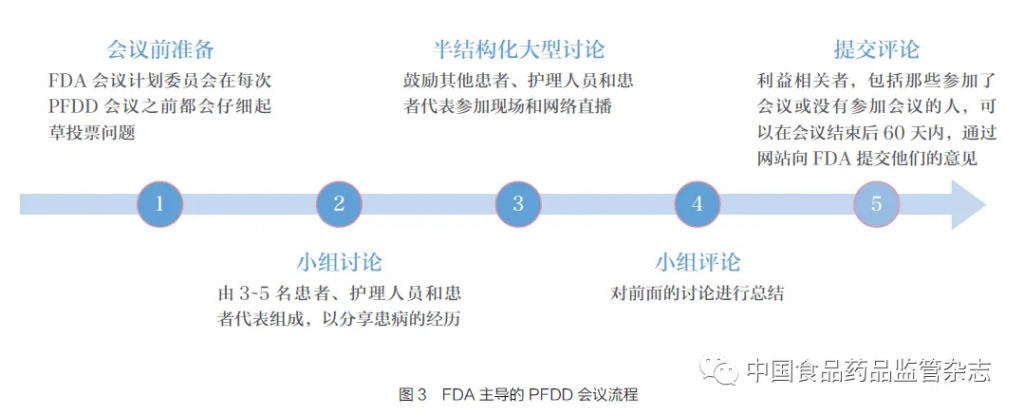
2012~2017 年,FDA 举行了24 次针对特定疾病的PFDD 会议,会议为FDA、患者团体、研究人员、药物开发商、医疗专业人员等主要利益相关方提供了聆听患者声音的机会。会议流程如图3 所示,在会前,FDA 会议计划委员会仔细起草投票问题;再由3~5 名患者、护理人员和患者代表组成小组进行讨论,分享患病的经历;然后进行半结构化大型讨论,与更多利益相关者交流;通过小组评论,对之前的讨论进行总结,最后提交评论意见;同时会议结束后60 天内,患者以及利益相关者可以通过网站向FDA 提交相关意见。
患者团体被认为是收集病人观点的有用资源,FDA 鼓励患者团体举行外部主导的PFDD 会议,并邀请罕见病患者组织制定行业建议草案。患者团体具有独特的视角,了解患者疾病,还拥有大量潜在参与者,这些优势使患者群体能够承担起重要的责任。为了进一步扩大患者参与人群,FDA 欢迎患者团体使用FDA 主导的PFDD 会议建立的流程作为模型,组织以患者为中心的合作,在更多的疾病领域鼓励患者发声,收集患者信息。
3.3 患者声音对于获益- 风险评估的作用
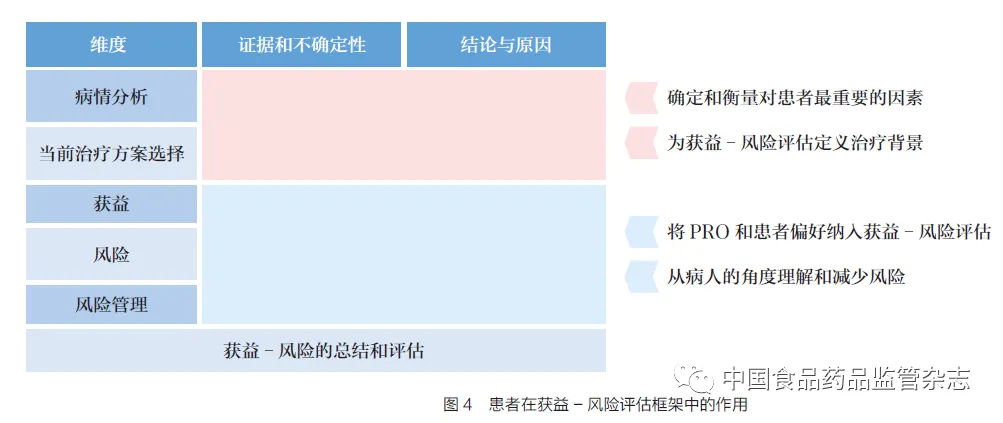
在药品研发阶段,患者声音可以为监管方提供决策信息。药物开发和监管决策需要进行获益- 风险评估。在平衡药物的获益和风险时,需要对不确定性的最大可接受程度作出判断,以实现预期的健康获益。传统上,这些决策依赖于专家的临床意见,但是,患者在利弊权衡方面的偏好可能不同于临床医生,因此在获益-风险评估中需要考虑患者的观点。FDA在《处方药使用者付费法案》第六次重新授权后对获益- 风险评估作出改变,以增加清晰度、透明度和一致性。随着《21 世纪治愈法案》的通过,FDA 必须考虑将PED 和相关信息纳入结构化的利益- 风险评估框架中,为监管决策提供依据。FDA 开发了结构化获益- 风险框架,更加系统地评估药品的获益和风险。患者在获益- 风险评估中同样有着十分重要的作用,如图4 所示,审评员可以通过患者声音了解哪些重要因素会对患者生理功能和生活质量产品影响;同时,患者声音在当前治疗方案选择中可以为获益-风险评估提供相关治疗背景,比如目前的治疗在多大程度上满足了患者群体的医疗需求。PRO 及患者对治疗的偏好在获益方面能为临床终点提供信息;在风险方面,可以了解患者对风险的最大接受程度。风险是可接受的,但不可控的风险是不可接受的,从病人角度理解和管理风险是很有必要的。比如,那他珠单抗最初于2004年被批准用于多发性硬化症,因该药存在导致进行性多灶性白质脑病的风险,药企自愿退市,但患者仍然坚信该药物的获益大于风险,最终FDA 决定该药可重新上市,并制定了风险最小化计划,为患者和临床医生提供更好的风险分析背景。
04 如何科学收集患者声音
高质量的PED 对于基于证据的决策至关重要。为保证PED 的可靠性与有效性,应参照GCP 部分原则对收集过程进行标准化规定。
收集PED 前应认真设计研究方案。研究方案应包含指导PED 收集的基本要素,包括研究目的、结果选择的理由和收集方法。临床研究前,需要给受试者提供知情同意书,在收集PED 前,也应该提供知情同意书,列明收集PED 的目的、所需时间和实施时间等。收集PED 的研究方案确定后,未经方案制定者的授权就无法修改。
在数据管理方面,数据缺失是将数据调查整合到临床研究中的最大障碍,为此可以设置PED 核查员。PED 存储以及访问权限,可以根据GCP 存储和维护原始文档和数据的要求,将研究调查和任何纸质数据保存在双锁或安全的空间中,并将研究ID 密钥与研究数据以及任何标识信息分开存储以确保机密性。电子存储的数据应保存在受防火墙保护、受密码保护的服务器中。包含研究数据和记录的研究原始文档和电子数据库应予以保留。
为确保成功收集PED,应对研究人员进行相关培训,包括数据收集的目的和价值,以及如何避免偏见。
对患者进行相关教育也十分关键。除了向患者详细说明数据收集的具体步骤外,患者教育还应强调加强PRO 研究的目的和价值、诚实回应的重要性、管理模式,以及完成调查的重要性。
当研究完成时,研究人员应当审查文档以确保数据的完整性,并立即解决不一致的地方。
05 展 望
5.1 加强患者对药物研发的认识
尽管PFDD 预计可以为患者提供更好的治疗方案,但患者对药物开发认识不足可能是患者参与的重要障碍。为了使患者对药物研发和生命周期管理作出积极贡献,需要帮助他们了解药物研发涉及的过程。同时,利益相关方也应该认识到患者在药物开发过程中的价值。
5.2 制定相关法律法规
FDA 的PFDD 概念最初是在《FDA 安全及创新法案》(Food and Drug Administration Safety and Innovation Act)和《处方药使用者付费法案》第五次重新授权中提及,之后又得到了《21 世纪治愈法案》和《处方药使用者付费法案》第六次重新授权的进一步支持。目前我国还没有制定关于将患者视角引入医药产品开发的法律法规。没有法律的界定,就很难在监管决策中实施。为了突出患者在药品开发和疗效评价中的重要性,应该在立法上提供依据。
5.3 加强真实世界研究
真实世界研究代表了药物开发研究的一种新方向,真实世界研究是指在真实医疗过程中,根据患者的实际病情和意愿非随机选择治疗措施,对药物开展长期评价。以患者为中心的真实世界数据可以助力药物开发,进一步满足患者需求,提高药物治疗的依从性。临床试验研究结论不能充分代表目标人群,而真实世界研究可以纳入复杂情况的患者,充分考虑患者需求,更具有临床实用性。2020 年1 月,国家药监局药品审评中心发布了《真实世界证据支持药物研发与审评的指导原则(试行)》,标志着将患者的治疗感受、生活质量、经济负担等角度收集的真实世界数据用于药物评估和开发将成为可能,也使得以患者为中心的药物开发成为可能。但真实世界证据最大的问题就是新数据来源所带来的技术和方法学挑战,真实世界研究中数据处理和实验设计会带来许多新的难题,如偏倚较大、成本较高(如开发数据库等带来的成本)等问题。高质量的数据在当前的真实世界研究中仍是一个需要加强研究的问题。
5.4 加强患者在药物研发过程中的
参与程度
PFDD 正在发展成为药物研发过程中必不可少的部分,因此,需要在药品研发过程中加强患者的参与程度,由相关部门牵头,制定系统地收集患者观点的方法和制度,在开始关键的临床试验之前,让患者能够早期参与药物开发,以确保药物适合患者的实际需求。